СО2 больше в мягкой воде. Миф или нет?
4936 - 11.10.05 в 08:51:59
СО2 больше в мягкой воде. Миф или нет?
Не могу понять, правда ли это?
В ветке про рецепты бражек http://www.aqa.ru/fo... вдруг поднялся этот вопрос:
сообщение ашык
в общем, почему в жесткой воде надо растворить больше СО2 для достижения его искомой концентрации мне вроде понятно.
А мне до сих пор не понятно. Может поделитесь мыслями по этому поводу?
а вот почему жёсткая вода должна как-то препятствовать самому растворению СО2 - не очень.
Разделяю данную мысль. Хотя это и не очень важно - всегда можно применить активный реактор и насильно растворить все СО2 без остатка.
Может быть, кто-нибудь возьмется объяснить по каким причинам в жесткой воде концентрация свободного СО2 может быть ниже, чем в мягкой, если был растворен одинкавый объем СО2?
Для понятности объяснения предлагаю следующую модель:
1. Взяли 1 литр дистиллированой воды, полностью растворили в ней 10 мг углекислого газа.
2. Взяли 1 литр дистиллированной воды, развели в ней 1 г бикарбоната натрия , полностью растворили 10мг СО2.
Почему концентрация свободного СО2 в случае 2 может оказаться меньше? Если она может оказаться меньше, то на сколько?
4936 - 11.10.05 в 08:59:26
Дабы освежить в памяти обсуждение "формулы толстяка" предлагаю перечитать тред http://www.aqa.ru/fo...
Я так понимаю, что участник с ником layka в том обсуждении и есть в теперешнем воплощении уважаемый Советник ашык.
5730 - 11.10.05 в 09:17:33
Эмипирическое объяснение дает принцип ла-шателье, кол-во примесей вляет на равновесие, скорость и направление реакций.
Изменено 11.10.05 автор Fylhtq
1293 - 11.10.05 в 11:08:26
САВА, ты ле-шателье не пугай, ты на пальцах давай, на пальцах:)
первое утверждение я себе объясняю так:
для того чтобы в воду с выраженным бикарбонатным буфером надуть сколько-то свободного СО2, надо чтобы сначала существенная часть растворяемого СО2 израсходовалась на образование угольной кислоты - чтобы "пробить" бикарбонатный буфер.
но почему буфер должен препятствовать самому растворению СО2?
p.s. да, конечно, layka это был мой ник в 2002 г.
736 - 11.10.05 в 11:45:23
Позвольте вставить наблюдение из практики.
Достичь уровня СО2 (по таблицам рН-кН) в 20-30 мг/л для местной воды (кН=24) мне удалось используя только reactor 100 от Aqua Medic, причем он работал на полную (не менее 3 пузырьков /сек, время подачи управлялось контроллером рН). Сейчас я использую осмосную воду, кН=6, подачу СО2 в реактор уменьшил до 1-1.5 пузырька/сек, большую часть времени (на вскиду соотношение 2-3:1) контроллер перекрывает подачу газа. При этом число растений только увеличилоь (потребление СО2), пузыряние (визуально) не хуже.
Насытить СО2 в банке смог бы и гораздо менее производительный реактор. Т.е . с падением кН СО2 растворяется значительно легче.
Объяснение - удел специалистов в данном вопросе. Могу только высказать предположение, что вначале СО2 уходит на образование гидрокарбонатов (которые разлагаются растениями или сами по какой-либо причине) и только после этого образуется угольная кислота, которая и сдвигает рН.
2602 - 11.10.05 в 12:04:12
по каким причинам в жесткой воде концентрация свободного СО2 может быть ниже, чем в мягкой, если был растворен одинкавый объем СО2?
Согласен с предыдущими ораторами. На примере раствора соды несколько упрощенно я бы это сформулировал так:
1) в растворе бикарбоната натрия NaHCO3 всегда присутствует и карбонат Na2CO3. Присоединяя либо отделяя углекислый газ и воду одно переходит в другое, и между их концентрациями имеет место химическое равновесие.
2) При растворении СО2 в растворе соды часть углекислого газа уходит на реакцию
Na2CO3+CO2+H2O -> 2NaHCO3
поэтому концентрация свободного СО2 оказывается в итоге ниже, чем в случае дистиллированной воды.
почему жёсткая вода должна как-то препятствовать самому растворению СО2?
хотя такое утверждение (что в жесткой воде CO2 хуже растворяется), и высказывалось неоднократно, мне это остается непонятным. Подозреваю, что это все-таки не совсем так: жесткая вода не препятствует растворению СО2 как таковому, она препятствует сохранению СО2 в воде в свободной форме (см. выше).
5730 - 11.10.05 в 12:11:02
сообщение ашык
но почему буфер должен препятствовать самому растворению СО2?
На пальцах не получится, можно только порассуждать 
Сам процесс растворения некоторая реакция итоговый продукт которой угольная кислота т.е. свободный со2. Для того чтобы газу растворится и образовать молекулу кислоты нужно получить доступ к свободной молекуле воды. Примеси уменьшают кол-во этих свободных молекул, образуя гидтратированые узлы
Например:
0-NA(+)-0
0 это связаные молекулы, которые могут быть недоступны для процесса растворения газа. Т.е. увеличивая примесь ты уменьшаешь кол-во свободных молекул. Т.е. со2 растворяется хуже.
Так сказать вольные фантазии на пальцах с помощью ла-шателье 
Если вернутся в буферу, то конечно карбонат сожрет много со2 при преобразовании в гидрокарбонат
NA2(CO3) + CO2 + H2O= 2NAHCO3
1970 - 11.10.05 в 12:13:45
сообщение ашык
но почему буфер должен препятствовать самому растворению СО2?
Да, не должен.
4936 - 11.10.05 в 12:30:10
сообщение Dmitrii
1) в растворе бикарбоната натрия NaHCO3 всегда присутствует и карбонат Na2CO3.
сообщение Fylhtq
Если вернутся в буферу, то конечно карбонат сожрет много со2 при преобразовании в гидрокарбонат
NA2(CO3) + CO2 + H2O= 2NAHCO3
Одна исходная посылка, вроде, прорисовывается -
растворяя 1г NaHCO3 в 1 литре чистой воды, мы получаем не только раствор NaHCO3, но и раствор Na2CO3.
Зато возникают новые вопросы:
Почему он должен появиться?
Раз появился карбонат натрия, следовательно выделилось некоторое количество CO2?
Если этот СО2 никуда не ушел из раствора, то именно такое количество CO2 и понадобится на "сжирание" только что образовавшегося карбонатного буфера. В чем тогда проблема?
Изменено 11/10/05 автор Sebastian Pereira
2602 - 11.10.05 в 12:52:29
Почему он должен появиться?
В результате реакции
2NaHCO3=Na2CO3 + CO2 + H2O.
Эта реакция всегда идет как в прямом направлении, так и в обратном. Химическое равновесие достигается когда скорости этих двух противоположных процессов совпадают. Так что в воде всегда присутствуют как карбонат так и бикарбонат.
Раз появился карбонат натрия, следовательно выделилось некоторое количество CO2?
Да. См. выше.
Если этот СО2 никуда не ушел из раствора, то именно такое количество CO2 и понадобится на "сжирание" только что образовавшегося карбонатного буфера.
В том-то и дело, что в случае с природной жесткой водой этот СО2 уже давно ушел.
Если же речь идет об искуственно приготовляемом растворе, то в сухом порошке бикарбоната натрия всегда присутствует также и карбонат, по тем же самым причинам.
1293 - 11.10.05 в 12:59:26
стоп. что-то тут не то.
"угольная кислота" не равно "свободная углекислота".
угольная кислота это два катиона водорода и анион СО3--
в одном из написаний уравнения про рН в числителе и угольная кислота (2Н+ и СО3--), и свободный СО2.
карбонатов в аквариумной воде очень мало - они малорастворимы. дело и в них, но далеко не только в них.
насыщению свободным СО2 препятствует именно бикарбонатный буфер - или, точнее, углекислотно-бикарбонатный буфер - смесь угольной кислоты и ее солей от сильного основания, т.е. бикарбонатов.
куда-то бикарбонат отыгрывает СО2...
гхм... получается, в угольную кислоту, т.е. в водород и карбонат:)
чёрт, напишите уже кто-нибудь формулы - как это всё выглядит на бумаге:):)
5730 - 11.10.05 в 13:02:59
сообщение ашык
стоп. что-то тут не то.
"угольная кислота" не равно "свободная углекислота".
угольная кислота это два катиона водорода и анион СО3--
в одном из написаний уравнения про рН в числителе и угольная кислота (2Н+ и СО3--), и свободный СО2.
На самом деле равно. Казус - ужос. Втыкнуть с первого раза невозможно :D
Растения употребляют в виде H2CO3, H+ и OH- используется для поддержания нейтрального заряда. Я предупреждал про ужос :D
1293 - 11.10.05 в 13:10:09
нет, не равно.
http://www.ecolife.o...
Диоксид углерода содержится в воде в основном в виде растворенных молекулCO2, и лишь малая часть его (около 1%) при взаимодействии с водой образует угольную кислоту
5730 - 11.10.05 в 15:29:57
Глубоко копаешь, ашык  . Самый прикол в том, что таблицы зависимости Кх-ph-co2 расчитаны по равновесию H2CO3-HCO3-, т.е. изначально предпологается, что свободный со2 есть суть угольная кислота. Казус
. Самый прикол в том, что таблицы зависимости Кх-ph-co2 расчитаны по равновесию H2CO3-HCO3-, т.е. изначально предпологается, что свободный со2 есть суть угольная кислота. Казус 
Вобщем памятник тому, кто систематизирует и привяжет к балансу по растворению, в зависимости от жосткости, и потреблению 
4936 - 11.10.05 в 16:36:48
Может быть, это поможет кому-нибудь в рассуждениях 1.4. Углекислотное равновесие ?
Там и про Ле-Шателье вспомнили  , правда, в том смысле, что CaCO3 может выпасть в осадок и исчезнуть из системы.
, правда, в том смысле, что CaCO3 может выпасть в осадок и исчезнуть из системы.
Но все равно хочется пока рассмотреть простой случай, когда ничего не улетучивается и не выпадает в осадок, т.е. случай бикарбоната натрия.
Изменено 11/10/05 автор Sebastian Pereira
6241 - 11.10.05 в 18:31:27
сообщение ашык
не понял, где числитель, где что, но эта формула, вообще-то о том, сколько надо газа, чтобы свалить pH бикарбонатного буфера до 7.0 при определённых условиях.
Почему это?
Как раз тут http://www.aqa.ru/fo...
Женя Подсыпальников, когда первый раз огласил эту формулу пишит: "Нужный ритм пузырьков легко рассчитать, зная КН и объем воды в литрах (V), грубо:
Число пузырей в минуту N = (KH * V) / 30 " и далее "И, конечно же, формула не для понижения рН газом. "
Именно основываясь на этих знаниях я и сказал, что от КН зависит необходимая скорость пузыряния.
Я где то не прав? Что то упустил?
сообщение Sebastian Pereira
Может быть, кто-нибудь возьмется объяснить по каким причинам в жесткой воде концентрация свободного СО2 может быть ниже, чем в мягкой, если был растворен одинкавый объем СО2?
Если говорить в продолжение темы "рецептов для бражки", то не понял суть вопроса. Более справедливо слово "растворен" заменить на "подан". С чего вы взяли что если газ подается с одинаковой скоростью и в мягкую и в жесткую воду, то он с одинаковой скоростью растворяется?
Изменено 11.10.05 автор Buldozer
2602 - 11.10.05 в 20:06:55
сообщение Sebastian Pereira
Может быть, это поможет кому-нибудь в рассуждениях 1.4. Углекислотное равновесие
Да, это стандартные формулы. Именно на основе формулы (1.11) и рассчитываются пресловутые таблицы, связывающие содержание свободного СО2, рН и щелочность, в предположении, что щелочность обусловлена только ионами НСО3-.
CaCO3 может выпасть в осадок и исчезнуть из системы.
Выпасть в осадок еще не значит исчезнуть из системы. Выпавший в осадок CaCO3 может опять перейти в Са(HCO3)2 и раствориться при повышении концентрации свободного СО2. Это и наблюдается - при закачивании СО2 в воду известковый налет на листьях растворяется.
Так или иначе, буферные свойства системы обеспечиваются связыванием СО2 при переходе карбонатов в гидрокарбонаты по приводишемуся выше уравнению, независимо от того идет речь о растворенных карбонатах, или выпавших в осадок.
1293 - 11.10.05 в 20:33:11
Buldozer, в середине треда про "пузырьки СО2 на пальцах" есть объясненение с цифрами - почему это так.
в треде http://www.aqa.ru/fo... формула была приведена тобой в качестве реплики на соображение Sebastian Pereira - и, на мой взгляд, не вполне к месту.
ведь это формула стартовой безопасности - и от кН с объёмом, конечно, безопасная скорость пузыряния ещё как зависит;)
но ближе к делу.
какой хитрый торговец чёрным деревом Sebastian Pereira, задал же задачу:):):)
читаем: Из уравнений диссоциации угольной кислоты в водном растворе следует, что соотношение между ее формами СО2, НСО3- и CO3-- ... зависит от концентрации водородных ионов
что, кстати, и отражает уже приводившаяся красивая картинка с процентными кривыми этих ионов.
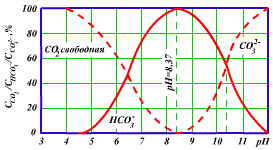
даём ответ:
накачивая СО2 в буфер, мы увеличиваем кол-во водородных ионов (протонов), чем снижаем рН.
чем больше протонов, тем большее количество угольной кислоты способно находиться в форме свободной СО2.
чем толще буфер, тем больше нам надо СО2, чтобы создать достаточно протонов, которые и позволят СО2 находиться в свободной форме.
а посередине нагнетаемый СО2 будет расходоваться на образование новых ионов CO3-- и НСО3-.
уфф...
p.s. при этом и Na2CO3+CO2+H2O -> 2NaHCO3 имеет место быть, конечно. но всё, повидимому, не так просто.
p.p.s. очень жаль, что этот форум покинули настоящие химики Игорь Чеботарёв и Вадим Лисовский - с ними разобраться в вопросе было бы много проще.
Но, может, настоящий химик GeneZ всех рассудит?
а то я, признаться, не очень уверен в правильности своего ответа:):):)
2602 - 11.10.05 в 21:04:21
Возвращаясь к вопросам в первом сообщении в этой ветке:
сообщение Sebastian Pereira
Почему концентрация свободного СО2 в случае 2 может оказаться меньше?
На мой взгляд, причина - это именно связывание свободного СО2 за счет преобразования карбонатов в гидрокарбонаты. Впрочем, это не мое изобретение, именно так всегда и везде и трактуется принцип работы карбонатного буфера.
Те же соображения, которые высказал Ашык - оно может и умно, но как-то уж очень туманно.. и сыро (проклятая осень.. :)). Может если б сформулировать это более четко, то оно и правильно, а так... я пока остаюсь при своем исходном мнении.
Если она может оказаться меньше, то на сколько?
А вот на сколько именно - это уже надо считать. Надо выписать уравнения равновесия для имеющих здесь место реакций, дополнить их балансными уравнениями и совместно их решить. Думаю, для той упрощенной формулировки задачи, которая была предложена (СО2 полностью растворяется, ничего не выпадает в осадок и не уходит в воздух) этого будет достаточно. Дело это нехитрое, и давным-давно уже надо было бы это сделать. Если никто из "настоящих химиков" здесь в ближайшее время не даст ответ, то может я все-таки соберу волю в кулак и решу в конце концов эту элементарную задачку. :)
1293 - 11.10.05 в 21:14:11
то может я все-таки соберу волю в кулак и решу в конце концов эту элементарную задачку.
ага, значит не оскудела химиками земля aqa.ru
просим, просим
4936 - 11.10.05 в 23:52:47
Да...
Все стало еще запутаннее.
Ставлю мысленный эксперимент 
Берем чистую обессоленную, обезгаженную воду.
Там существует какая-то равновесная концентрация ионов водорода, допустим pH=7.
Начинаем растворять бикарбонат натрия. pH сдвигается в большую сторону и становится больше, чем 8.37.
Равновесие реакции 2NaHCO3=Na2CO3 + CO2 + H2O смещается слегка вправо.
Небольшая часть бикарбоната натрия разлагается на карбонат и углекислый газ. (Неужели простое растворение соли в воде заставит pH раствора повысится настолько, что произойдет реакция разложения?! Кстати, реакция, на мой необразованный взгляд, в том виде как она написана - необратима, т.к. СО2 запросто может выйти из нее  ).
).
ОК. Имеем раствор карбоната и бикарбоната натрия.
Начинаем растворять CO2. Образуются дополнительные ионы водорода.
Сначала мы должны возместить ушедший CO2 и превратить карбонат снова в бикарбонат. Эта часть газа действительно расходуется впустую - ботве этот углекислый газ не достанется.
Дуем дальше. pH понижается, карбоната больше нет, кругом одни ионы HCO3.
Доходим до заветной величины из графика, когда равновесие уже начинает наблюдаться между свободным CO2 (а может, и H2CO3 - это так и осталось невыяснянным  , но неважно, ботве видимо уже наплевать, она готова кушать все что угодно, CO2, H2CO3).
, но неважно, ботве видимо уже наплевать, она готова кушать все что угодно, CO2, H2CO3).
Дуем дальше. А дальше тупик - дальше НСО3 уже не может превратиться в CO2 и еще что-то, иначе куда деваться натрию?
СО2 приходится растворяться безнаказанно.
Ничего не понимаю.... Где буфер?
1970 - 12.10.05 в 08:16:00
Интересно читать все эти соображения, но на мой взгляд, эффективность растворения СО2 звависит (в основном) от окисляемости воды (ХПК). Жесткость воды влияет в значительно меньшей степени.
На практике, в слабоокисленной воде СО2 растворяется плохо. 
4936 - 12.10.05 в 09:26:32
сообщение igor2
Интересно читать все эти соображения
Прошу принять во внимание, что мой предыдущий пост с "мысленным экспериментом" был не более, чем бредом.
Я по прежнему продолжаю считать, что содержание свободного СО2 не зависит от жесткости воды, т.е. от концентрации заранее введенного в воду HCO3- в виде соды.
Просто наличие этого иона не позволяет pH сразу и быстро понизиться при растворении CO2.
8850 - 12.10.05 в 09:41:27
Странная штуковина происходит с банкой.
Прикупил СО2 Денерле Эксклюзив 5000, думал что растючка попрёт с космическим темпом, но увы ошибся. Как было так и есть, причём борода не убежала как обещали.
Недавно перенес банку на кухню, вода рядом, начал делать почаще подмены, бороды больше стало.
Летом, когда времени практически небыло, воду только подливал, борода исчезла.
У кого какое мнение на сей счёт.
P.S. Можно поискать Юрий Маркхот, это одно и тоже, адреса разные.
С уважением.
5730 - 12.10.05 в 11:27:36
сообщение Sebastian Pereira
Я по прежнему продолжаю считать, что содержание свободного СО2 не зависит от жесткости воды, т.е. от концентрации заранее введенного в воду HCO3- в виде соды.
Это противоречит ла-шателье 
4521 - 12.10.05 в 11:34:24
сообщение Юра Маркхот
Странная штуковина происходит с банкой...
Рискну предположить недостаток каких-то других питательных веществ, кроме углекислого газа.
У меня, например, в одной из банок нитраты выжираются под ноль и растения постоянно на полуголодном пайке, все быстро зарастает нитчаткой. Особенно это ярко проявляется после 4-5 недель непрерывного пузыряния - СО2 хватает, а вот нитратов - полный ноль.
4936 - 12.10.05 в 11:36:18
сообщение Fylhtq
Это противоречит ла-шателье 
Раз знаешь, чем именно это противоречит, тогда объясняй на пальцах куда девается CO2 
А то ведь так и закончу жизнь в своем глупом заблуждении 
5730 - 12.10.05 в 11:44:14
сообщение Sebastian Pereira
сообщение Fylhtq
Это противоречит ла-шателье 
Раз знаешь, чем именно это противоречит, тогда объясняй на пальцах куда девается CO2 
А то ведь так и закончу жизнь в своем глупом заблуждении 
Итак давай примем определения:
Чистая вода - воде без примесей.
Жосткая вода - вода с примесями в достаточном количестве, чтобы эта вода не была чистой.
Гипотеза - СО2 в жосткой воде расворятся хуже или содержание свободного со2 меньше - истина. Почему это так?
Потому, что по принципу ла-шателье направление и скорость реакций для чистой воды и жосткой разные. Ясно?
Изменено 12.10.05 автор Fylhtq
5730 - 12.10.05 в 11:48:21
Да, еще, давайте таки чатится в пределах нашего научного бреда, с конкретными ситуациями наверно лучше в отдельные темы.
1293 - 12.10.05 в 14:46:22
более того, так как совершенно понятно, что концентрация свободного СО2 при растворении заданного его количества в реальном аквариуме с жёсткой водой будет ниже, чем в реальном аквариуме с мягкой водой, я предлагаю разбираться исключительно с модельной ситуацией из первого топика треда, но модернизированной:
1) 1 литр дистиллированной воды + 100 мг бикарбоната натрия (продутые до достижения равновесной концентрации СО2) + 10мг СО2.
2) 1 литр дистиллированной воды + 1000 мг бикарбоната натрия (продутые до достижения равновесной концентрации СО2) + 10мг СО2.
т.о. мы будем разбираться с моделями более близкими к реальности.
чем дольше я об этом думаю, тем больше запутываюсь.
неужели дело только в разных концентрациях карбоната этих двух растворов? и точно ли они будут разными?
5730 - 12.10.05 в 15:11:43
сообщение ашык
1) 1 литр дистиллированной воды + 100 мг бикарбоната натрия (продутые до достижения равновесной концентрации СО2) + 10мг СО2.
2) 1 литр дистиллированной воды + 1000 мг бикарбоната натрия (продутые до достижения равновесной концентрации СО2) + 10мг СО2.
Нет это абстракцейя. Без равновесных реакций ничего не понять.
Вот такая здравая мысль, в воде с буфером расход со2 будет больше, но не потому, что он хуже растворяется, а потому, что нужны дополнительные затраты на реакцию равновесия буфера.
Т.е. расход будет = расход дистиялта + дельта (зависящая от буфера). Собсно дельта и будет в принципе ла-шателье.
4936 - 12.10.05 в 20:04:43
сообщение Fylhtq
в воде с буфером расход со2 будет больше, но не потому, что он хуже растворяется, а потому, что нужны дополнительные затраты на реакцию равновесия буфера.
Т.е. расход будет = расход дистиялта + дельта (зависящая от буфера).
А какова реакция равновесия буфера?
Неужели Na2CO3+CO2+H2O -> 2NaHCO3 ?
4936 - 12.10.05 в 20:06:52
сообщение Fylhtq
Чистая вода - воде без примесей.
Жосткая вода - вода с примесями в достаточном количестве, чтобы эта вода не была чистой.
Гипотеза - СО2 в жосткой воде расворятся хуже или содержание свободного со2 меньше - истина. Почему это так?
Потому, что по принципу ла-шателье направление и скорость реакций для чистой воды и жосткой разные. Ясно?
Ура! Теперь все стало предельно ясно! 
736 - 13.10.05 в 08:21:59
сообщение Юра Маркхот
...начал делать почаще подмены, бороды больше стало.
Летом, когда времени практически небыло, воду только подливал, борода исчезла.
У кого какое мнение на сей счёт.
Юрий, в троицкой воде (в Геленжик подается из Новороссийска) высокий уровень фосфатов, выше ПДК. В этом и причина.
8850 - 13.10.05 в 08:49:25
YRus
У меня вода из Дивноморска, там скважины огромные.
Но недалеко от меня сходятся в один узел и Дивноморская и Троицкая, где давление больше, та и идёт по трубам.
1970 - 13.10.05 в 09:18:16
сообщение Sebastian Pereira
сообщение Fylhtq
Гипотеза - СО2 в жосткой воде расворятся хуже или содержание свободного со2 меньше - истина. Почему это так?
Потому, что по принципу ла-шателье направление и скорость реакций для чистой воды и жосткой разные. Ясно?
Ура! Теперь все стало предельно ясно! 
А что ясно ?
Какие ты выводы сделал, поделись с народам ! 
Интересует практическая сторона. 
4936 - 13.10.05 в 18:48:58
сообщение igor2
сообщение Sebastian Pereira
Ура! Теперь все стало предельно ясно! 
А что ясно ?
Какие ты выводы сделал, поделись с народам ! 
Стало ясно, что пора идти в магазин за учебником по общей химии и читать про принцип Ле Шателье, химическое равновесие, обратимые реакции, закон действующих масс и прочее.
Иначе, если никто так и не сможет просто и убедительно и понятно объяснить в чем тут дело, то придется по прежнему считать, что концентрация СО2 зависит только от количества растворенного нами газа и не зависит от жесткости. А вдруг это неправильно? 
Вот такой вот практический вывод. 
5730 - 14.10.05 в 07:49:11
сообщение Sebastian Pereira
сообщение Fylhtq
в воде с буфером расход со2 будет больше, но не потому, что он хуже растворяется, а потому, что нужны дополнительные затраты на реакцию равновесия буфера.
Т.е. расход будет = расход дистиялта + дельта (зависящая от буфера).
А какова реакция равновесия буфера?
Неужели Na2CO3+CO2+H2O -> 2NaHCO3 ?
Вот так
Na2CO3+CO2+H2O 2NaHCO3
5730 - 14.10.05 в 07:52:00
сообщение igor2
Какие ты выводы сделал, поделись с народам ! 
Интересует практическая сторона. 
Выводы достаточно тривиальные, нулевой буфер и расход со2 будет минимальным, а форма и скорость употребления по-максимуму. Как у эдварда вобщем. 
4936 - 15.10.05 в 00:34:28
сообщение Fylhtq
Вот так
Na2CO3+CO2+H2O 2NaHCO3
Учебник еще не купил, поэтому не совсем врубаюсь в проблему. Тем не менее порассуждать хочется 
Возьмем подобную реакцию
СаCO3 +CO2+H2O Ca(HCO3)2
По принципу ЛШ выведение из системы вещества способствует его образованию.
Теперь мы посадим в достаточно крепкий раствор Ca(HCO3)2 какое-нибудь растение.
Это растение, если оно не совсем глупое, тут же выведет из системы CO2. CaCO3 при этом всяко выпадет в осадок. Тем самым мы выводим из системы продукты разложения Ca(HCO3)2.
Значит ОЧЕНЬ СКОРО о наше растение будет расти в дистиллированной воде (с KH=0 и GH=0), покрытое коркой нерастворимого известняка. Особенно, если бы наш воображаемый аквариум находился в атмосфере чистого азота и кислорода, вместо банального воздуха, который все-таки подло содержит некоторое количество углекислого газа.
Это явление мы должны наблюдать в большинстве аквариумов, не подвергающихся искусственному добавлению CO2.
А это действительно так?
1293 - 15.10.05 в 22:17:01
типа, осенило:D
в умной ссылке хитрого торговца чёрным деревом есть такие слова: ионная сила раствора.
чего они обозначают, я представляю смутно - но может дело как раз в них.
смотрите: "смесь угольной кислоты и ее солей от сильного основания".
берём натрий и кальций, оба от сильных оснований, но карбонат кальция малорастворим, а карбонат натрия ещё как растворим.
и не следует ли из этого, что буферный раствор из карбоната кальция будет переваривать углекислоту не так, как буфер из карбоната натрия или из их смеси?
а если это так, то мы вообще ничего никогда не посчитаем.
химики, вы вмешайтесь уже, а?
________________________
Sebastian Pereira, теоретически, растение С4, т.е. умеющее потреблять углерод из гидрокарбоната, в объёме, изолированном от источников СО2 (атмосфера, дыхание гидробионтов, минерализация органики), так и должно себя вести.
по мере съедания им гидрокарбоната, карбонат будет опять растворяться.
потом углерод кончится.
и этого не происходит из-за постоянного поступления СО2 в систему.
_________________________
извиняюсь за оффтоп:
а можно попросить модератора грохнуть из этого треда топики, не относящиеся к теме?
просто грохнуть, без уведомлений и объяснений причин?
готов продолжить обсуждение последнего предложения в ином месте.
4936 - 15.10.05 в 22:43:28
сообщение ашык
берём натрий и кальций, оба от сильных оснований, но карбонат кальция малорастворим, а карбонат натрия ещё как растворим.
и не следует ли из этого, что буферный раствор из карбоната кальция будет переваривать углекислоту не так, как буфер из карбоната натрия или из их смеси?
Да, они точно должны вести себя немного по разному. Это даже я понимал, когда задавал хитрый вопрос :). Хотя, здесь уже говорилось, и я согласен, что выпадение в осадок вовсе не означает выведение из системы - из атмосферы или еще откуда поступит новая порция CO2, растворится и потом углекислота растворит выпавший осадок. Поэтому, в некотором смысле, все равно что создает буфер - хоть бикарбонат натрия, хоть кальция или магния.
растение С4, т.е. умеющее потреблять углерод из гидрокарбоната, в объёме, изолированном от источников СО2 (атмосфера, дыхание гидробионтов, минерализация органики), так и должно себя вести.
по мере съедания им гидрокарбоната, карбонат будет опять растворяться.
потом углерод кончится.
и этого не происходит из-за постоянного поступления СО2 в систему.
Я имел ввиду простое растение, умеющее кушать только CO2. В этом случае процесс будет напоминать кипячение воды с разложением гидрокарбонатов, улетучиванием CO2 в атмосферу и выпадением в осадок слаборастворимых солей кальция и магния.
Но, как верно подмечено, этого не происходит из-за постоянного поступления СО2 в систему.
Наверно, если удалить из воздуха CO2, то "кипячение" воды растениями так бы и происходило.
4936 - 15.10.05 в 22:48:35
Теперь, когда с теорией, вроде бы понятно, хотелось бы уже говорить о количествах того или иного вещества, участвующего в процессе.
1293 - 15.10.05 в 22:56:08
ну, я бы не сказал, что с теорией так уж всё понятно.
как было, так и осталось - догадки на ходу.
а практическая сторона вопроса (первого из вопросов)вообще отсутствует - и так всё понятно.
конечно, в "жестководном" аквариуме мела найдётся больше, чем в "мягководном".
4253 - 16.10.05 в 22:01:47
Я так тоже встряну дабы тредов не разводить :)
Вот питерская вода очень мягкая. У нас тут kH=2. Я собираюсь вдувать СО2, но и pH=6.5, есть риск, что pH упадет или будет колбаситься от дня к ночи со страшной силой. Как бы так поднять буфер не изменив активную реакцию в сторону щелочности, т.к. насколько я помню неоны и трава любят мягкую водицу. Если я что то ляпнул противоестественное химии, прошу меня грамотно зачморить и показать почему я не прав.
4936 - 16.10.05 в 22:22:42
сообщение MuFF-T
У нас тут kH=2. Я собираюсь вдувать СО2, но и pH=6.5
При pH-6.5 и KH=2 вдувать CO2 необязательно - его содержание итак уже около 19 мг/л.
Смотри http://www.dennerle....
При KH=2 и равновесном содержании CO2 (примерно 0.5%) pH должно быть около 8.1  Что-то не так с тестами?
Что-то не так с тестами?
4253 - 16.10.05 в 22:36:08
сообщение Sebastian Pereira
сообщение MuFF-T
У нас тут kH=2. Я собираюсь вдувать СО2, но и pH=6.5
При pH-6.5 и KH=2 вдувать CO2 необязательно - его содержание итак уже около 19 мг/л.
Смотри http://www.dennerle....
При KH=2 и равновесном содержании CO2 (примерно 0.5%) pH должно быть около 8.1  Что-то не так с тестами?
Что-то не так с тестами?
табличку посмотрел.
Но СО2 в воде будет выжран во время светового дня. А откуда ему взяться как не из подмены или из внешнего источника? Даже если он придет из атмосферы, то его концентрация не достигнет 20 мг/л.
Тесты не врут. Факт остается фактом. В воде из под крана того круче при буфере = 2, активная реакция = 6.
Изменено 16-10-2005 автор MuFF-T
5730 - 17.10.05 в 07:28:08
сообщение Sebastian Pereira
Теперь мы посадим в достаточно крепкий раствор Ca(HCO3)2 какое-нибудь растение.
Это растение, если оно не совсем глупое, тут же выведет из системы CO2. CaCO3 при этом всяко выпадет в осадок. Тем самым мы выводим из системы продукты разложения Ca(HCO3)2.
Нет не так. Если в воде где растет это растение нет СО2 и СО2 не поступает извне, то на листьях начнет образовываться гидроокись кальцея
Ca(HCO3)2 -> 2CO2+ Ca(OH)2. Т.е. процесс защелачивания и гибели будет необратим.
Изменено 17.10.05 автор Fylhtq
4936 - 18.10.05 в 20:45:01
сообщение Fylhtq
Нет не так. Если в воде где растет это растение нет СО2 и СО2 не поступает извне, то на листьях начнет образовываться гидроокись кальцея
Ca(HCO3)2 -> 2CO2+ Ca(OH)2. Т.е. процесс защелачивания и гибели будет необратим.
Ок. Может и так.. . Но случай и впрямь довольно гипотетический.
5730 - 19.10.05 в 08:01:33
сообщение Sebastian Pereira
Ок. Может и так.. . Но случай и впрямь довольно гипотетический.
Ну да, выкинуть пополнение углеродом из атм., баллона или еще как, просто невозможно.
2602 - 21.10.05 в 14:49:25
Итак, рассматриваем задачу:
"В 1л дистиллированной воды растворили Х мг бикарбоната натрия и Y мг СО2. Сколько свободного СО2 будет в воде?"
Для упрощения предполагаем, что СО2 в воздух не уходит, а также и не приходит дополнительно из воздуха, и в осадок ничего не выпадает, и все реакции внутри раствора приходят к равновесию. Это, конечно, далеко от реальной ситуации, но пока ограничиваемся такой упрощенной постановкой задачи.
Решается эта задача очень просто, путем совместного решения уравнений равновесия и балансных уравнений. Если кому интересно, могу изложить это подробно и представить результаты в виде каких-нибудь таблиц или графиков.
Надо сразу сказать, что в жесткой воде свободный CO2 будет содержаться даже в том случае, если он извне в нее не вводился, т.е. при Y=0. Откуда он там возьмется - а благодаря реакциям NaHCO3->NaOH+CO2 и 2NaHCO3->Na2CO3+CO2+H2O. Это количество СО2 небольшое, но оно есть.
Далее, при растворении в воде Y мг СO2 часть его уйдет на перевод карбоната обратно в бикарбонат Na2CO3+CO2+H2O->2NaHCO3, а часть перейдет в гидрокарбонатный ион просто в результате диссоциации CO2+H2O->H+ + HCO3-. Так что содержание свободного СО2 увеличится меньше чем на Y. Но ненамного меньше, так как при разумных значениях X и Y на оба эти процесса расходуется относительно небольшое количество СО2. Так что в представляющей наибольший интерес области параметров и при указанных упрощениях Sebastian Pereira прав - сколько СО2 растворяем, примерно столько свободного СО2 в воде получаем.
Несколько частных случаев для иллюстрации.
Z - содержание свободного СО2 в воде в мг/л.
Для справки также приведено и устанавливающееся значение pH:
1) X=0, Y=10, Z=9.6, pH=5
2) X=10, Y=0, Z=0.1, pH=8.1
3) X=10, Y=10, Z=10, pH=6.1
4) X=100, Y=0, Z=0.6, pH=8.3
5) X=100, Y=10, Z=10, pH=7.1
6) X=1000, Y=0, Z=5.9, pH=8.3
7) X=1000, Y=10, Z=12.8, pH=7.9
Изменено 24-10-2005 автор Dmitrii
4936 - 21.10.05 в 20:24:55
сообщение Dmitrii
Итак, рассматриваем задачу:
"В 1л дистиллированной воды растворили Х мг бикарбоната натрия и Y мг СО2. Сколько свободного СО2 будет в воде?"
....
сколько СО2 растворяем, примерно столько свободного СО2 в воде получаем.
Несколько частных случаев для иллюстрации.
Z - содержание свободного СО2 в воде в мг/л.
Для справки также приведено и устанавливающееся значение pH:
1) X=0, Y=10, Z=9.6, pH=5
2) X=10, Y=0, Z=0.1, pH=8.1
3) X=10, Y=10, Z=10, pH=6.1
4) X=100, Y=0, Z=0.6, pH=8.3
5) X=100, Y=10, Z=10, pH=7.1
6) X=1000, Y=0, Z=4.8, pH=8.5
7) X=1000, Y=10, Z=11.9, pH=8.1
Итак, Dmitrii героически решил задачу, и тем самым развеял старый миф меньшем содержании углекислого газа в жесткой воде!!:smart:
Ура!
Насколько я понимаю, 100мг/л бикарбоната натрия соответствует примерно измерямой тестами КН=3-4 градуса. Таким образом, в диапазоне КН от 0 до 40 градусов, да и существенно дальше, видимо, жесткость воды не влияет на количество свободного CO2.
Получается, что худший рост растений в жесткой воде при растворении равного количества CO2 связан в значительной степени с высоким pH, а не с недостатком CO2.
Также получается, что отрегулировав один раз количество пузырьков в единицу времени, растворяемых в одном, отдельно взятом аквариуме, мы получим одно и то же содержание углекислого газа независимо от жесткости воды, которую мы в нее зальем - хоть дистиллированную, хоть очень жесткую. Если потребление растениями CO2 день ото дня не изменяется, то не нужен никакой pH-контроллер, достаточно счетчика пузырьков.
6609 - 22.10.05 в 18:24:40
Если потребление растениями CO2 день ото дня не изменяется, то не нужен никакой pH-контроллер, достаточно счетчика пузырьков.
100%
для браги лучший пых контроллер - стакан неизменной площади - пых как заговоренный. Мерять нечего. Балону наверно и подавно - любой реактор. Только настрой раз.
Вадим.
4936 - 22.10.05 в 23:20:16
сообщение VladHNet
100%
для браги лучший пых контроллер - стакан неизменной площади - пых как заговоренный. Мерять нечего. Балону наверно и подавно - любой реактор. Только настрой раз.
Вадим.
Брага как раз и отличается от баллона переменностью количества пузырьков, выдаваемых в единицу времени. Если ваш реактор умеет растворять меньшее количество пузырьков, чем выделяет ваша брага даже в свои наиплачевные периоды, то да - содержание СО2 будет постоянным.
Я имел ввиду несколько другое. Мы растворяем некоторое количество пузырей целиком в единицу времени, например, с помощью активного реактора, и точно знаем при этом, что содержание СО2 не зависит от карбонатной жесткости нашей воды. От нее будет зависеть только равновесный пых, будь мы в Питере, доливая воду из болот, или на Камчатке, доливая воду из гейзеров (не очень уверен, но думаю вода должна быть там довольно жесткой, возможно, ошибаюсь  , тогда из источников Боржоми, неужели она там тоже мягкая
, тогда из источников Боржоми, неужели она там тоже мягкая  ?)
?)
6609 - 23.10.05 в 10:14:19
сообщение Sebastian Pereira
Брага как раз и отличается от баллона переменностью количества пузырьков, выдаваемых в единицу времени. Если ваш реактор умеет растворять меньшее количество пузырьков, чем выделяет ваша брага даже в свои наиплачевные периоды, то да - содержание СО2 будет постоянным.
Именно о таком реакторе я и говорил - это "стакан".
За счет постоянной площади растворения и глубины погружения (вторая как мне показалось погоды не делает) скорость растворения практически неизменна и зависит лишь от концентрации СО2 в воде, чем она ниже - тем выше скорость. Все что лишнее придет от браги и не успеет раствориться большим бульком уйдет на поверхность. Этим и хорош стакан.
Я заметил еще одну закономерность. При условии, что стакан не "принужден", т.е. не проточный, а в стоячей воде, после насыщении воды до уровня 30мг/л скорость растворения снижается, как-бы не в 2-3 раза. И пых как становится 7.0 (КН=9), так сколько ему СО2 в стакан не лей - 7.0 хоть ты тресни. Ниже завалить пых помогает либо проточность либо увеличение площади растворения. Вот такое "механический" пых контроллер получается. Почему? Не знаю. Я лишь описываю неоднократно замечаное.
Я имел ввиду несколько другое. Мы растворяем некоторое количество пузырей целиком в единицу времени, например, с помощью активного реактора, и точно знаем при этом, что содержание СО2 не зависит от карбонатной жесткости нашей воды.
Это поняно. Просто я привязывался не к этому, а к фразе что не нужен пых контроллер и развил эту мысль так-же и в отношении браги.
ЗЫ. одно время меня осенила мысль повторить аналоговый пых контроллер с ручной калибровкой и ЖКИ, с целью получить онный в ценовой категории до 100уе, дабы был доступен массам, но заметив вышеописанное я начал понимать людей, сомневающихся в необходимости пых контроллера и забросил эту затею как безперспективную.
Вадим.
4253 - 23.10.05 в 13:29:36
Уважаемые, я в принципе понял вашу мысль. Т.к. мы используем, реактор-стакан - площадь контакта СО2 с водой остается постоянным и не будет изменяться в зависимости от "столба" (читай объема) газа в стакане, и единственное что требует это эмперически установить площадь дна стаканчика. (я не смогу рассчитать это, даже приблилизельно - нет знаний).
6609 - 23.10.05 в 13:46:36
сообщение MuFF-T
я не смогу рассчитать это, даже приблилизельно - нет знаний
А зачем расчитывать, можно и подобрать площадь меряя пых. Я так и сделал. Можете как ориентир взять 100см2 площади и 500мл обьема на каждые 50л при условии непроточности стакана. Я пришел методом перебора стаканов именно к таким цифрам. Затем меряете пых и смотрите табличку.
Минус реакторов типа стакан - их габариты, т.к. для 240л банки потребуется уже 500см2 и 2,5л (это 10х50х5см)
Вадим.
4253 - 23.10.05 в 13:51:24
сообщение VladHNet
А зачем расчитывать, можно и подобрать площадь меряя пых. Вадим.
я и сказал  эмперически
эмперически 
с нашим буфером в питере надо быть аккуратно 
6609 - 23.10.05 в 14:56:48
сообщение MuFF-T
я и сказал  эмперически
эмперически 
с нашим буфером в питере надо быть аккуратно 
мне бы Ваш буфер  - почти халявный осмос
- почти халявный осмос 
хотя везде хорошо где нас нет 
Вадим.
4253 - 23.10.05 в 20:21:40
да .. вода у нас просто почти осмос 
ph-6, kh-2, gh-4  с другой стороны что нить пузырнуть очень сложно. Трудно содержать африку... Зато харацинка и дискусы прут
с другой стороны что нить пузырнуть очень сложно. Трудно содержать африку... Зато харацинка и дискусы прут 
6609 - 23.10.05 в 20:31:59
сообщение MuFF-T
ph-6, kh-2, gh-4  с другой стороны что нить пузырнуть очень сложно. Трудно содержать африку...
с другой стороны что нить пузырнуть очень сложно. Трудно содержать африку...
В смысле сложно пузырнуть?
Что есть африка?
Вадим.
4253 - 23.10.05 в 20:39:54
сообщение VladHNet
В смысле сложно пузырнуть?
Что есть африка?
Любые попытки давать СО2 очень сильно пугают обвалом ph.
А африка - это малави, танганьика.
1293 - 23.10.05 в 20:45:47
Но ненамного меньше, так как при разумных значениях X и Y на оба эти процесса расходуется относительно небольшое количество СО2.
Dmitrii, а этот вывод будет справедлив и для гидрокарбоната кальция?
потому что если это так, то действительно устойчивый миф серьёзно приблизился к своей смерти:)
правда, с практический точки зрения, это не миф - это так и есть.
но ведь при достаточно долгом пузырянии всякие меловые отложения должны в жестководном аквариуме буквально кончиться - уйти с подменами.
т.о., если дело не в "пробивании" буфера, а в выведении из системы слаборастворимых карбонатов, то, следовательно, нам останется только определиться - препятствует ли буфер самому процессу растворению СО2?
4936 - 23.10.05 в 21:58:34
сообщение Dmitrii
Если кому интересно, могу изложить это подробно и представить результаты в виде каких-нибудь таблиц или графиков.
Мне очень интересно. Не столько таблицы и графики, сколько подробное решение задачи. Опубликуйте, пожалуйста!
6241 - 24.10.05 в 11:55:22
сообщение MuFF-T
Любые попытки давать СО2 очень сильно пугают обвалом ph.
А вы не пугайтесь, а подавайте
Лично по моей практике РН никогда неснижался ниже 6-и
2602 - 24.10.05 в 12:30:21
Я там у себя в расчете нашел ошибку, в формуле для коэффициентов активности. Для малых и средних жесткостей это несущественно, а при больших начинает проявляться. Сейчас исправил, цифры для случаев (6) и (7) получаются немного другие (см. отредактированное сообщение от 21-10-2005 13:49). Впрочем, общую картину это практически не меняет.
Насколько это все переносится на случай гидрокабоната кальция надо еще разбираться. Подозреваю, что переносится почти без изменений. Но возможность выпадения карбоната в осадок здесь все-таки создает некоторую сложность. Надо еще немного книжку почитать, чтобы научиться такие гетерогенные системы рассчитывать.
Насчет подробного изложения решения - договорились, распишу все как есть. Может по пути еще какие ошибки найду. 
4253 - 26.10.05 в 10:36:23
сообщение Buldozer
А вы не пугайтесь, а подавайте
Лично по моей практике РН никогда неснижался ниже 6-и
подаю уже. Перемерил pH пока 7. Брага какая то квелая. Бутылка на 1 литр, сухие дрожжи в качестве старта. Но пузыряет от силы раз в 3 секунды. Пока какого либо видимого эффекта мало.
4936 - 26.10.05 в 20:12:42
сообщение MuFF-T
сообщение Buldozer
А вы не пугайтесь, а подавайте
Лично по моей практике РН никогда неснижался ниже 6-и
подаю уже. Перемерил pH пока 7.
Для СПб pH=7 - это все равно что не подавать СО2 совсем...
Чтобы при KH=2 опустить pH ниже 6 - это надо задувать до 60 мг/л. Сделать такое 1 литровой брагой вовсе не просто!
 . Самый прикол в том, что таблицы зависимости Кх-ph-co2 расчитаны по равновесию H2CO3-HCO3-, т.е. изначально предпологается, что свободный со2 есть суть угольная кислота. Казус
. Самый прикол в том, что таблицы зависимости Кх-ph-co2 расчитаны по равновесию H2CO3-HCO3-, т.е. изначально предпологается, что свободный со2 есть суть угольная кислота. Казус 




 ).
). 
