|
Посетитель
  |
Химизм реакции лимонной кислоты с бикарбонатом натрия и его зависимость от давления. |
|
подробный разбор для проектировщиков систем на ПЭТ бутылях. |
|
|
21/12/2016 13:23:11
#2317356 Нравится oltrew
|
|
Посетитель
  |
|
|
Только сейчас сообразил. По мере расходования CO2 давление в системе будет падать, и реакция пойдет дальше. То есть будет эффект частичного редуктора. |
|
|
21/12/2016 13:53:46
#2317371 |
|
|
|
Постоянный посетитель
   |
|
FerrumCat Не редуктора, а аккумулятора. У редуктора давление на выходе постоянно, до тех пор пока давление на входе выше или равно заданного давлению на выходе. |
|
|
21/12/2016 14:38:16
#2317382 |
|
Свой на Aqa.ru
     |
|
|
Так ребята, стоп! Чего то я не понимаю. Какое изменение давления, где? У меня стоял манометр на аппарате. Давление в процессе поднималось всего лиш на 0,5 атмосфер! |
|
|
21/12/2016 20:29:20
#2317550 |
|
Постоянный посетитель
   |
|
Hedin Вы о каком изменении давления пишете??? Автор темы написал подробно, как проекает реакция лимонки с содой, разбил эту реакцию на последовательные этапы и показал зависимость от внешних условий. Еще бы автор темы источник этой информации указал, было бы вообще прекрасно. 
|
|
|
21/12/2016 22:24:45
#2317606 |
|
Посетитель
  |
|
|
Источник информации - Московский Химико-Технологический институт им. Д.И. Менделеева. Я там 5,5 лет учился. И, к моему удивлению , еще что-то помню! |
|
|
22/12/2016 13:04:28
#2317806 |
|
Свой на Aqa.ru
     |
|
FerrumCat Как эту информацию можно использовать? До 10атм незачем поднимать давление( и как такое давление поднимешь). Веточку продавливает 1атм, а дифффузор примерно нужно 1,5 - 2атм. 10атм и для промышленного оборудования многовато. Изменено 22.12.16 автор WViktor |
|
|
22/12/2016 13:38:03
#2317834 |
|
Свой на Aqa.ru
     |
|
|
Меня смутили строки: Так, если в ходе реакции за счет выделения CO2 давление повысится до 10 атм, то получим ... |
|
|
22/12/2016 21:09:25
#2317967 |
|
Постоянный посетитель
   |
|
Hedin FerrumCat рассматривает процесс не в конкретном генераторе, а в закрытой емкости, когда ЛК и сода загружаются одновременно. При этом давление зависит от количества реагентов и объема емкости. Просто изложена последовательность реакций и их зависимость от внешних условий. По этому теоретически давление может быть любым. Но при этом FerrumCat показывает, что с ростом давления реакция идет не до конца, но проходит полностью при снижении давления. Hedin ... Более интересными могли быть данные по влиянию объёма жидкости в системе, её площади и пр. Вы не единожды обращали внимание на этот вопрос. Могу предположить, что эта зависимость связана с конкретной реализацией генератора, а именно генератора Славкина, которой Вы придерживаетесь. А именно не полным охватом зоной подаваемой кислоты зоны соды в бутылке. И чем более широкое дно, тем меньше пересекаются зоны распространения кислоты и соды. Такая же картина скорее всего получается и при увеличении количества воды в системе. Славкин предложил решение, но на него ни кто не обратил внимание. Надо перевернуть бутылки крышками вниз. Тогда сода постоянно будет перемещаться под действием силы тяжести практически в одну точку, в крышку, за счет конфигурации бутылки в виде воронки. В эту же точку (на крышку) надо подавать и кислоту. Это конечно не решит проблему полностью, но во многом нивелирует указанную Вами зависимость. Умозрительно наиболее правильно, в случае с перевернутыми бутылками, использовать высокие бутылки с узким плавно сужающимся горлышком, типа таких:  Изменено 22.12.16 автор kichrot |
|
|
22/12/2016 22:50:55
#2318005 |
|
Посетитель
  |
|
|
Для пользователей модифицированного аппарата Киппа (с постоянным невысоким давлением)из этой темы полезна информация , что выход СО2 по лимонной кислоте будет не выше 80%, и это при том, что лимонная кислота - самая дорогая из применяемых в этом процессе. |
|
|
23/12/2016 10:00:26
#2318094 |
|
|
|
Посетитель
  |
|
Hedin Именно поэтому я и стал экспериментировать с системой с предварительной накачкой. В ней давление в системе никогда не превосходит рассчитанного, и ничего никогда не лопнет - раньше кислота израскходуется, чем давление дойдет до кртитческого. |
|
|
23/12/2016 10:03:40
#2318095 |
|
Завсегдатай
    |
|
FerrumCat Теория это здорово. Еще бы нашелся другой химик, способный ее проверить на ошибки.. Но как быть с Бутыль среднего давления как абсолютно безопасный источник СО2 ? Каждый может легко проверить, пожертвовав истины ради несколько грамм кислоты. Да, манометр нужен. Практика не показывает никакого заметного уменьшения выхода газа при доступных для ПЭТ давлениях. Изменено 24.12.16 автор oltrew |
|
|
24/12/2016 13:47:58
#2318487 |
|
Постоянный посетитель
   |
|
|
Вот нашел у братьев белорусов:
В формате .XLS Подробнее по основным в-вам: Лимонная кислота C6H8O7, она разная бывает. Безводная (ангидрид) молярная масса 192 г/моль, растворимость в воде 133 г/100мл, насыпная плотность - 0,76. Моногидрат (встроена молекула воды), молярная масса 210, растворимость 162 г/100мл (недостоверно). Если написано ГОСТ Р 53040-2008 или CAS 77-92-9, то это безводная. Если написано ГОСТ 908 или CAS 5949-29-1, то моногидрат. А если ГОСТ 3652-69 или ТУ 9199-001-18293020-00, ТУ 9199-029-00334557-99, ТУ 9199-039-17910261-11, то может быть и водная и безводная. В прод. магазинах чаще продается моногидрат. Пишут, что под видом лимонной иногда продается китайская винная кислота. Безводная сильнее напитывает влагу и слеживается в комки - можно пощупать пакетик. Моногидрат на воздухе выветривается - теряет воду. Если заморачиваться точностью концентраций, то расфасованную кислоту желательно взвешивать и на увеличившийся нетто вес безводной отнимать воду, а на выветрившийся нетто вес моногидрата добавлять воды. Но нам особая точность не нужна - абы СО2 давала. Сода пищевая NaHCO3 (гидрокарбонат натрия), молярная масса 84 г/моль, растворимость 9,6 г/100мл (20С), насыпная плотность (0,7-1), хорошо напитывает влагу. Соды для полной реакции должно быть с избытком, тем более она дешевая. Значит, весовая пропорция сода/кислота не менее 1,5 для безводной и 1,3 для моногидрата. Сода напитывает влагу, насыпная плотность может быть намного больше паспортной - как-то измерял свежекупленную - была 1,2 кг/л. Продолжение подробного обзора кислот-солей будет позже... и может кто добавит свои СО2-прикладные химические знания. Глядя на табличку, удобнее делать выводы о неприменимости, сложности, неэффективности применения некоторых в-в или об их необходимых концентрациях в растворе. Пример с растворимостями: При реакции 100 г лимонной кислоты с пищевой содой образуется 134 г Цитрата натрия (ЦН), растворимостью 72г/100мл (25 C). А воды всего 28 и 34 г. При насыщении (а может и раньше) ЦН выстесняет из раствора значительно менее растворимую соду. В насыщенном растворе цитрата натрия вместо 96 г/л соды будет всего 13 г/л, т.е. в 7,5 раз меньше (пропорционально растворимостям). Такое сильное изменение концентрации соды в растворе заметно увеличивает химический гистерезис и разгоняет давление. От 100 г безводной кислоты образуется 134,4 г ЦН. Для его полного растворения нужно добавить не менее 159 мл воды. При использовании моногидрата нужно добавлять не менее 137 мл воды на 100 г кислоты. С учетом присутствия в растворе еще соды, на 100 г лимонной кислоты должно быть (округлил) не менее 200 г воды для безводной и не менее 150 г воды для моногидрата. Почти такая же ситуация с уксусной кислотой. При реакции 100 г 70%-ной эссенции с пищевой содой образуется 95,7 г ацетата натрия растворимостью 76г/100мл. А воды всего 30 г. Значит для НЕпоявления в зоне реакции нерастворимого осадка ацетата натрия, воды в соде должно быть не менее 110 г на каждые 100 г эссенции (с учетом еще растворенной соды). А эссенция и 80%-ная бывает... Для чего в таблице плотности? Если раствор не перемешивать, он расслаивается по плотностям. Например, при реакции лимонной кислоты с содой: плотность воды - 1 г/см³ лимонной кислоты - 1,542 цитрата натрия - 1,70 пищевой соды - 2,16 Если капать лимонную кислоту НА раствор соды, то без перемешивания вверху исчезает сода и будет формироваться бОльшая концентрация воды с кислотой отделенная от соды концентрацией цитрата натрия. Проникновение за счет диффузии медленное, а при случайном смешивании случится бурная реакция. Поэтому и нужно раствор кислоты подавать ПОД соду. Такая же картина и с уксусной кислотой. Проблема Цитрата натрия имеет 3 варианта развития событий: 1. ЦН выпадает в осадок при при пропорциях "Вся_вода_в_системе:Кислота" менее 1,58:1 для безводной, 1,52:1 для моногидрата. С учетом растворенной соды, вытесняющей ЦН и плохого перемешивания эту пропорцию следует увеличить до 2:1. Итак, пропорция "Вся_вода_в_системе:Кислота" менее 2:1 может вызвать выпадение в осадок ЦН, образование корки. 2. При большей пропорции воды или на ранних стадиях, до насыщения, ЦН еще не выпадает осадок, но постепенно вытесняет из раствора менее растворимую соду. Это увеличивает химических гистерезис, растягивает время реакции и для реакторов под давлением разгоняет давление. Без давления, возможно, будет вполне сносно работать в таком режиме какое-то время. 3. Плохое перемешивание при подаче кислоты "НА соду". Без перемешивания жидкости в растворе расслаиваются по плотностям. Плотности: вода - 1; лимонная к-та - 1,542; цитрат натрия - 1,7; сода - 2,16. Будет расслоение концентраций: сода внизу, раствор воды с кислотой вверху, между ними раствор ЦН. Такое расслоение также увеличивает химических гистерезис, растягивает время реакции, но главное, при взбалтывании вызывает бурную реакцию. И вообще - последствия малопредсказуемы - какое-то время затухание, замедление, потом где-то кислота проникла - начинается более бурное газовыделение. Короче - нестабильно и непредсказуемо. Возможны также смешанные варианты. Например, и нет перемешивания, и мало воды. Как следствие - и корка, и вытеснение, и расслоение. Тема интересная и полезная, желательно ее закрепить. |
|
|
25/12/2016 20:20:50
#2318890 Нравится serg_42
|



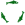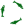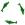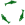 Загружаю
форму....
Загружаю
форму....