|
Премодератор, Советник
 |
Вода залита, когда запускать рыб? Азотный цикл в аквариуме легко и просто. |
|||||||||||||||||||||||||||||||||
|
Запуск аквариума состоит из простых шагов: автор Button AQA.RU
Прошла пара часов, дней или даже неделя, вода уже почти кристальная, почему, нельзя запускать рыб? Рыб так не хватает в аквариуме... но следующий шаг все же: 5. Читать об азотном цикле, и ждать, пока он запустится в вашем аквариуме. Вы залили в аквариум чистую водопроводную, но мертвую воду, для рыб такая вода не пригодна, рыбы живут в симбиозе с бактериями. Чтобы чистая водопроводная вода превратилась в живую воду нужно терпение, потому что процесс этот не быстрый.
6. Азотный цикл - это ерунда, запускали сразу - все живы и счастливы. Рыбы обладают запасом прочности, если они едят и плавают это инстинкты, а не *счастье*. Рыбы не могут рассказать вам, как им плохо, они просто продолжают плавать и есть. К сожалению, многие рыбы, получившие шок, стресс или подвергшиеся отравлению мертвой водой в аквариуме, сильно подорвут здоровье и иммунитет, а значит проблемы и болезни лишь вопрос времени. Рыбы с подорванным иммунитетом (в результате неправильного запуска) постоянно будут добавлять вам проблем. Здоровые рыбы живут долгие годы, когда за ними правильно ухаживают, и они действительно счастливы.
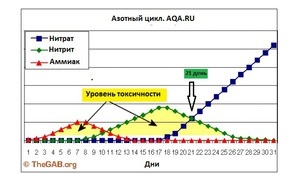
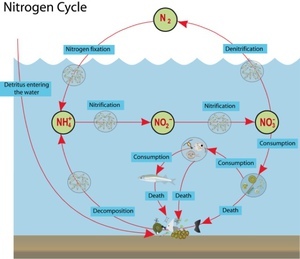
Заселение аквариума полезными бактериями проходит в три стадии. Первая неделя. Образутеся аммиак (NH3) и аммоний (NH4). Аммиак/аммоний токсичны для рыб и креветок. Рыб запускать нельзя.
Так аммиак или аммоний, что именно образуется? Это зависит от параметров воды. При рН
Вторая неделя. Образуется нитрит NO2. Нитритное отравление все еще опасно для рыб и креветок. Рыб запускать нельзя. Далее нужны нитрифицирующие бактерии (NOB) или бактерии-нитрификаторы, которые будут переводить опасные, токсичные для рыб, азотные соединения (аммиак), в неопасные для рыб и полезные для растений. До того, как эти бактерии не появятся в аквариуме - вода опасна для рыб, и может стать причиной отравлений и болезней (кровоизлияние, покраснение жабр). В дальнейшем, при заселении в аквариум гидробионтов (рыб, креветок и т.д) аммиак и аммоний будут образовываться в результате жизнедеятельности рыб, продуктов гниения, например, корма и растений. Процесс перевода бактериями опасных для рыб соединений в неопасные (нетоксичные) называется нитрификацией, иногда азотным циклом. Процесс идет в два этапа с участием двух разных групп бактерий.
NH3 + 1,5O2 + НАДН2 → NO2- + 3H+ + H2O + НАД+ Третья неделя. Нитрит NO2 начинает перерабатываться бактериями в нитрат NO3.
NO2− + H2O → NO3− + 2H+ + 2e− Примечание: если нужно больше информации ищите Автотрофная нитрификация.
Как проверить что происходит в воде? Готова ли воды? Тесты для воды.
Тестами на аммиак (NH3) и аммоний (NH4) проверяют начался ли процесс нитрификации, в готовом аквариуме тесты не обнаруживают данные соединения. Их быть не должно. (Но, если они обнаруживаются, то определить что именно образовалось аммиак или аммоний, можно только зная рН, поскольку тест их не различает, просто показывает наличие.) Если есть аммиак/аммоний, то рыб запускать нельзя.
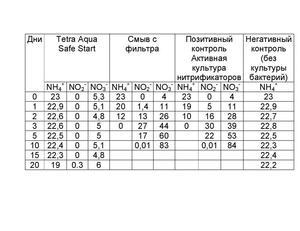
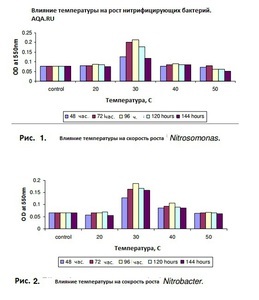
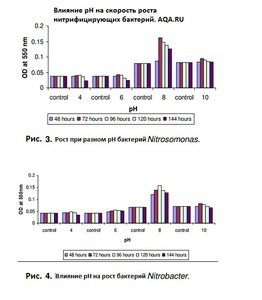
Так вот, на глаз, вы не сможете определить ничего из вышеописанного, даже, если вода кристально чистая визуально. Исключение в данном случае, это опыт многих запусков и понимание поведения грунта, знание параметров свой воды и возможность визуального определения качества воды в аквариуме по состоянию растений и другим малозаметным признакам, но это приходит только с многолетним опытом. Как ускорить процесс нитрификации и сократить его раза в 2? Чтобы получить заметные результаты нужно добавить активных бактерий-нитрификаторов обеих групп в аквариум, тогда в плане изменения контрольных параметров воды становятся заметны спустя сутки, а если мы рассматриваем параметры, которые критичны для гидробинтов, такие как быстродействующий аммиак, и медленнодействующие нитриты, то нужно примерно 10 дней. Откуда взять активных бактерий обеих групп? Самое лучшее средство это вода из уже запущенного старого аквариума, или оттуда же: грунт, выжимка из фильтра, сам фильтр, растения и т.п. Так же это могут быть специальные препараты для запуска аквариума, которые продаются в аквариумных магазинах, но эти средства менее эффективны, по сравнению с живой культурой бактерий. Если взять живых бактерий неоткуда, то придется ждать. Как уже выше сообщалось, скорость размножения нитрифицирующих бактерий очень медленная. К примеру, если средняя скорость размножения бактерий вообще составляет 20-30 минут (прямое деление бактерий), то нитрификаторам нужно от 7 до 20 часов, в среднем, в зависимости от условий 15-20 часов (Nitrosomonas от 7 часов, Nitrobacter от 13 часов). Немного ускорить процесс можно подняв температуру до 30о С и привести рН к значению между 7 и 8,5 (что обычно соответствует параметрам водопроводной воды) и подачей кислорода через аэрацию. На графиках показаны результата исследований скорости размножения бактерий обеих групп, в зависимости от показаний рН и температуры. Естественно, перед посадкой рыб нужно привести значения к характерным для существования выбранного вида. Эксперименты с контрольными замерами фирменных препаратов:и Тестирование препаратов для запуска аквариума (НИТРИФИКАЦИЯ). Так когда можно запускать рыб? 6. Запускать рыб можно, когда заработают обе группы нитрифицирующих бактерий: аммиак будет непрерывно перерабатываться в нитрит, а нитрит в нитрат. То есть в воде они не будут накапливаться (и определяться тестами). И поможет тут только время. 7. ПОДМЕНЫ воды в аквариуме После установления азотного цикла в аквариуме происходит постоянный процесс переработки аммиака/аммония в нитрит, а затем и в конечный продукт - нитрат (NO3). Он накапливается, и несмотря на то, что рыбы могут выдерживать постепенное повышение нитрата, и впоследствии даже высокие концентрации нитрата в воде - в выживать в тяжелых условиях, необходимы регулярные подмены, чтобы выводить постоянно накапливающийся нитрат.
Чем меньше объем и больше рыб, тем чаще делаются подмены.
Вывод: своевременно делайте тесты и подменивайте воду в аквариуме для долгой и здоровой жизни ваших питомцев.
1 Nitrate toxicity to aquatic animals: a review with new data for freshwater invertebrates, Julio A. Camargo, Alvaro Alonso, Annabella Salamanca Фотографии аквариума в разных стадиях запуска взяты из этой темы: Как запускать аквариум на грунте ADA (c фото) Роль фильтрации в нитрификации: Нитрифицирующая активность во внутреннем фильтре и аквариуме. Ответ на вопросы: Отключать или не отключать? А нужна ли фильтрация круглосуточно? и т.п. Изменено автор Olga K Button |
||||||||||||||||||||||||||||||||||
|
15/10/2016 13:05:48
#2284503 |
|
Премодератор, Советник
 |
|
|
|
Нитритное отравление. Симптомы. перевод Button AQA.RU
Нитрит (NO2) это промежуточное вещество, при преобразовании аммиака (NH3) в нитрат (NO3).
В любом случае больше всего нитрит поражает кровь гидробионтов. Из плазмы крови нитрит методом диффузии попадает в красные кровяные тельца, где окисляет железо гемоглобина (Hb) до степени +3 и трансформирует гемоглобин в метамоглобин, который уже больше не связывается с кислородом. Это сказывается на транспортировке кислорода в крови рыб, как недостаток кислорода. Кровь и жабры приобретают коричневый оттенок, как только количество метаглобина начинает составляет 20% от всего гемоглобина. Если рыбы остаются неактивны, то потребность в кислороде у них все ещё низкая и немедленного эффекта от присутствия нитрита можно не наблюдать, но если рыбы начинают проявлять какую-то активность, то начинают погибать от удушья. Некоторые особи, которые находятся в хорошем физическом состоянии и имеют большие запасы гликогена в печени, за счет этого могут выносить повышение количества метамоглобина в крови дольше других. Основные симптомы: рыбы темнеют, судорожно дышат, жабры коричневеют, рыбы не едят, малоподвижны. Степень выносливости рыбы (время до момента гибели) зависит от физического состояния, объема аквариума (условий содержания), размера самой рыбы и её вида. Примерное количество метамоглобина в крови, которое приводит к фатальным результатам - 50% от общего гемоглобина. Редкие виды лорикариевых способны выживать до 2-х дней при концентрации 100% метаглоболина в крови при температуру 25о С. Обратный процесс восстановления метамоглобина до гемоглобина в крови рыб, при условии нормализации параметров воды, происходит в течение 24-72 часов. В целом, максимальное воздействие нитрита на рыб происходит по прошествии 24-48 часов. Возможность летального исхода начинается после воздействия больше 24 часов. Возможность восстановления стремительно уменьшается, если время воздействия нитрита на рыбу составило от 96 часов. Литература: Nitrite influence on fish: H. KROUPOVA, J. MACHOVA, Z. SVOBODOVA Изменено 21.10.17 автор Button |
||
|
15/10/2016 16:12:33
#2284576 Нравится AquaDesignAmano, ВладимиРыбка, Сергей Шеховцов, Little_bagira, Олег Халиков и еще 18 пользователям
|
|
|
|
Премодератор, Советник
 |
|
|||
|
Отравление аммиаком в аквариуме.
Токсичность. Аммиак (NH3) относится к группе высокотоксичных для рыб соединений. Его токсичность обусловлена в основном действием недиссоциированных молекул. Аммонийные соли или аммоний NH4, в силу малой агрессивности ионов аммония, менее токсичны для рыб и их действие также в основном зависит от наличия свободного аммиака. Количество аммиака в аквариуме возрастает с повышением рН и температуры воды. Чем выше рН, тем больше окнцентрация опасного аммиака. Аммиак или аммоний, что именно образуется? Это зависит от параметров воды. При рН
Аммиак образуется в организме рыб как конечный продукт азотистого обмена и выделяется через жабры. Показать скрытый текст Хроническое отравление лососевых рыб наступает в течение 35 сут при концентрации 0,04 — 0,1; красноперки и других карповых — при 0,1 мг/л аммиака. Соли аммония менее токсичны. Пороговые концентрации перхлората аммония и азотнокислого аммония при хроническом воздействии соответственно в 10 и 2 раза ниже, чем остро летальные. Гибель бентосных организмов наступает при концентрациях аммиака 2,7 — 5 мг/л, зоопланктона — 0,2 мг/л, а солей аммония — в пределах 20 — 200 и 16 мг/л соответственно. Среднесмертельные концентрации нитритов при экспозиции 96 ч составляют для молоди форели 0,2 — 0,39 мг N02/л, нитратов — 4,7 — 6 мг/л. Токсические границы нитритов для карповых рыб находятся выше 0,5 мг NО2/л, нитратов — выше 3 мг NО3/л.
Симптомы и патоморфологические изменения. Аммиак является типичным нервным ядом, обладающим также гемолитическим и локальным действием. Картина острого отравления довольно характерна и проявляется однотипно у разных видов рыб. В начальной стадии постепенно повышается возбуждение и обостряется чувствительность рыб к механическим и световым раздражителям. Затем развиваются сильные клонико-тонические судороги, проявляющиеся как бы толчкообразными движениями рыб, дрожанием плавников. Рыбы теряют равновесие, опускаются на дно и лежат с широко раскрытым ртом, расставленными плавниками и жаберными крышками. Трупное окоченение хорошо выражено, поверхность тела и жабры обильно покрыты слизью, видны очаговые кровоизлияния. В высоких концентрациях аммиак вызывает дистрофию, вакуолизацию и некробиоз респираторного эпителия жабр и повышенное кровенаполнение внутренних органов, иногда некробиоз печеночных клеток. При более низких концентрациях сильнее проявляется гемолиз эритроцитов, нарушение функций нервной системы и дегенеративные изменения во внутренних органах. Признаки хронического отравления солями аммония малохарактерны: рыбы угнетены, не принимают корма. При воздействии перхлората аммония у карпа и форели отмечается дистрофия и некробиоз печеночных клеток, распад эпителия мочевых канальцев. Хлористый, сернокислый и азотнокислый аммоний, кроме того, вызывают деструкцию эпителия и коллоида щитовидной железы. В крови снижается уровень гемоглобина и уменьшается количество эритроцитов. Schreckenbach К. с соавт. считает, что основная причина бранхионекроза карпов — аутоинтоксикация аммиаком, накапливающимся в организме рыб. Патологический процесс в жабрах усиливается при повышении аммиака в воде. Характерные реакции рыб на действие нитритов — повышение в крови метгемоглобина на 20 — 60%. Диагноз ставят на основании симптомов болезни, патоморфологических изменений и результатов определения аммиака в воде и органах рыб. В воде определяют общий аммонийный азот колориметрическим способом с реактивом Несслера. Количество свободного аммиака рассчитывают, исходя из константы диссоциации аммонийных соединений при фактических значениях рН и температуры воды. Вначале по таблицам находят процентное соотношение ионов аммония и неионизированного аммиака, а затем рассчитывают их концентрацию в воде (мг/л). Нитриты и нитраты определяют официальными методами с реактивом Грисса. Показать скрытый текст Допустимые (критические) значения азотистых соединений а аквариуме: свободного аммиака — 0,05 мг/л, аммония солевого (NH4) — 0,5 — 1,0 мг/л, нитритов — 0,08 — 0,2 мг МО2/л, нитратов — 2 — 3 мг NO3/л, перхлората аммония — 0,044 мг СlO4/л. Литература: Болезни рыб: Справочник. - М.. Г. В. Васильков, Л. И. Грищенко, В. Г. Енгашев и др.; Под ред. В. С. Осетрова.. 1989. Изменено 4.11.17 автор Button |
||||
|
04/11/2017 17:03:09
#2427106 |
|
Премодератор, Советник
 |
Как стрессы при неправильном содержании влияют на иммунитет рыб |
|
При воздействии неблагоприятных условий рыбы подвергаются стрессу, что в свою очередь, снижает иммунитет и рыбы заболевают. |
|
|
28/07/2019 02:14:01
#2656770 |
|
Премодератор, Советник
 |
|
|
kH, GH, pH, CO2
автор Olga K Button Начнем с рН. Формула воды, как известно Н2О - атом водорода и два кислорода. Но в химии связь между этими атомами выглядит как Н+ и ОН- что показывает равновесие или баланс в этом соединении по химической активности каждой её части, то есть [H+]=[OH-]. Такая форма в химии называется ионы – заряженные частицы, где Н+ - ион водорода, а ОН- - гидроксильная группа. Если количество свободных, условно незадействованных в связях, ионов водорода [H+] равно [OH-] то это вода нейтральная, определяется это по количеству ионов водорода относительно гидроксильной группы. Но на это равновесие влияют и другие вещества, растворенные в воде, которые смещают это равновесие как в одну, так и в другую сторону. Если свободных ионов водорода больше, чем ионов гидроксильной группы, то вода становится кислой - рН понижается, а если их становится меньше, то рН возрастает. Таким образом, рН это водородный показатель, который определяет именно количество ионов водорода относительно гидроксильной группы. Сама величина, логарифмическая и отрицательная, поскольку поштучно считать ионы водорода невозможно и их считают сразу степенями 10-7, 10-6, то есть одно изменение рН это изменение в 10 раз. Еще раз, изменение показателя рН на одну единицу, означает изменение концентрации в 10 раз. Например, было рН 7 стало рН 6, значит отрицательная степень уменьшилась в 10 раз, другими словами ионов водорода стало в 10 раз больше. Если это равновесие рассматривать с точки зрения изменения свойств воды, то при большом количестве свободных ионов водорода вода становится кислой, а при маленьком – щелочной. KH и GH. Есть в природе щёлочные металлы, которые настолько химически сильные, что в реакции в водой образуют вот прямо щёлочи. Один из таких металлов – натрий (Na). А есть щёлочеземельные металлы, (в их числе кальций (Ca), магний (Mg) и др.) они не такие сильные, но все равно придающие щёлочность воде, нас именно они интересуют, поскольку тесты воды на kH, GH - все о них. Вода и углекислый газ, который так или иначе есть в воде, образуют угольную кислоту (H2CO3), а её соли, то есть реакция этой кислоты с активными металлами называется гидрокарбонаты (HCO3-). Гидрокарбонаты химически не очень стабильные. Все щелочеземельные металлы, вышеупомянутые, реагируют с угольной кислотой и образуют в воде гидрокарбонаты. Есть конечно и другие кислоты и соли, с которыми реагируют все активные металлы, тогда могут образовываться хлориды и сульфаты, а это уже вполне химически стабильные соли. То есть мы имеем условно два вида солей: нестабильные и стабильные. Нестабильные это гидрокарбонаты, они легко реагируют с другими веществами и тем самым, не дают сильно меняться водородному показателю pH, поэтому иногда их называют буфером. Это и есть КН, то есть KH это количество гидрокарбонатов и буфер для рН. А GH это все сразу соли кальция и магния: стабильные и нестабильные, то есть и гидрокарбонаты и сульфаты, и хлориды. Но бывают казусы, если в воду добавить пищевую соду (гидрокарбонат натрия NaHCO3), то натрий, как сильный металл отбирает хлориды и сульфаты у солей кальция (Ca) и магния (Mg), и оставляет им свой гидрокарбонат. А поскольку тесты KH и GH учитывают только соли и гидрокарбонаты кальция и магния, а натрий не учитывают, то КН по тестам становится больше GH. CO2 Гидрокарбонаты (они же бикарбонаты) это форма содержания углерода (C). Знаете, в чем отличие и главная проблема водных растений в сравнении с наземными? Ограничение доступа к углероду. Для наземных нет такой проблемы, поскольку воздух содержит достаточно углерода в виде углекислого газа. А у водных растений много ограничений, связанных с существованием в воде, и они вынуждены постоянно подстраиваться и потреблять углерод, какой есть в наличии. При чем, в воде углерод может присутствовать в виде 4 соединений: собственно CO2, угольная кислота (H2CO3), и в виде ионов: гидрокарбонат (HCO3-) и карбонат (CO3-), то есть растение должно уметь потреблять и доставать углерод из разных форм. Кстати, при высоком рН и чаще кустовые растения, получают углерод как раз из бикарбонатов, обычно это бикарбонат кальция. Другими словами, если нет более доступных форм, то растения вынуждены питаться гидрокарбонатами, за счет этого гидрокарбонатов становится меньше, однако, это не самый лучший для них вариант, но необходимость выживания. Им для роста нужен углерод, причем, так называемая жидкая форма углерода - это токсин, который растения, как и тяжелые металлы, утилизируют и накопляют в большом количестве, но когда настанет предел насыщения, то растение погибает. Вывод тут такой, что углекислый газ, как доступная форма углерода - самый предпочтительный для растений вариант. |
|
|
20/11/2020 11:55:54
#2840519 |










 Загружаю
форму....
Загружаю
форму....