|
Свой на Aqa.ru
     |
Натрий и калий :) (страница 10) |
|
Когда то давно, имел счастье обзавестись книжулькой, Цирлинг М. Б. „Аквариум и водные растения” Бегло пробежав, наткнулся на интересность. Она поставила меня в тупик. Раньше я полностью был уверен что калия должно быть в воде больше чем натрия, но в книги увидел другую версию. Натрий: Калий 4-5:1. У кого какие соображения? Первое что пришло на ум, минеральная соль от серы, там все это присутствует с приобладанием в разы натрия. Глянул состав Seachem Plant, там натрий в том же количестве что кальций с магнием. |
|
|
20/01/2013 10:25:18
#1761644 |
|
Свой на Aqa.ru, Советник
 |
|
666sb не кидайтесь в крайности. В голове почему-то сидит информация, что хлор в некоторых случаях может подменить нитрат. Но не уверен. нужно политать свои книжки. Ведь натрий и калий антагонисты, а в некотых случаях могут вполне успешно заменить друг друга. Сухие соли, особенно если они в комплексе(в одной таре), например: сульфат кальция и сульфат магния точно не отмеришь, т.к они должны иметь одну фракцию: в противном случае эта смесь будет иметь неоднородную структуру.если не верите, то засыпьте несколько видов круп в одну тару и потресите ее, а потом посмотрите как произойдет распределение. |
|
|
10/08/2013 18:23:05
#1850070 |
|
|
|
Завсегдатай
    |
|
Ananas72 передоз калия не так страшен в прсутствии натрия... и вот вопрос...сколько надо натрия в аквариуме? у меня пока: натрий 5 мгл калий 15-20 (собираюсь уменьшить) и еще... когда существенно увеличил калий- пришлось увеличить бор растения стали сильно куститься...при увеличении бора прошло ведь калий сдерживает бор? |
|
|
10/08/2013 18:39:02
#1850072 |
|
Завсегдатай
    |
|
Sebbb дак а что крайности?  просто посмотрел популярные составы реминерализаторов так кальция сульфат.... кальция сульфат- 3 руб мешок  я понимаю купить какое то дельное УДО или девайс.... а тут то смысл тратиться на кальция хлорид? |
|
|
10/08/2013 18:43:50
#1850073 |
|
Свой на Aqa.ru, Советник
 |
|
Ananas72 Ну у меня учебники в основном 80-х годов, ну может парочка посвежее. И есть такие, которые старше моего отца. Я читал в учебнике по гидропонике, что в Агрокомлексах в советское время проводили эксперимент: в теплицу искуственно нагнетали СО2 и доводили его до нескольких процентов и фиксировали увеличение скорости фотосинтеза и следовательно и общий рост растений. |
|
|
10/08/2013 18:45:32
#1850075 |
|
Завсегдатай
    |
|
Sebbb эта проблема решается легко посчитал..не знаю правильно или нет... на 1 ведро 10л надо кальция сульфат (в виде гипса) 1,3гр подмена 6 ведер- итого надо залить ~8гр кальция сульфат в чем проблема их отмерять? и какая принципиальная разница сколько именно попадет в каждое из 6-и ведер? Изменено 10.8.13 автор 666sb |
|
|
10/08/2013 18:47:28
#1850076 |
|
|
|
Завсегдатай
    |
|
Sebbb было такое но. после некоторого порога - шло снижение все хорошо но в меру |
|
|
10/08/2013 18:49:58
#1850077 |
|
Свой на Aqa.ru
     |
|
SebbbДумаю не секрет что на данный момент в колхозных теплицах на сей день дуют со2. Как пример хозяйство колхоза Урал. |
|
|
10/08/2013 19:08:31
#1850083 Нравится 666sb
|
|
Свой на Aqa.ru, Советник
 |
|
сообщение 666sb Ну вот как еще объяснить, что все идет в куче? Нужен сбалансированный состав воды, а не "добавил натрий, снизил (увеличил) рН". Возьмите состав воды в любой речке и проанализируйте его. Ссылку на состав воды в Амазонке и в Рио-Негро я уже давал. Вот, еще раз: http://en.wikipedia.... Там, кстати, не только неоны живут, но и цихлиды. Биофильтрация в травнике не нужна? Тогда вопрос: а зачем Вам в травнике биофильтр?  Кроме фильтра бактерии селятся везде, с чем контактирует аквариумная вода. |
|
|
10/08/2013 20:21:02
#1850107 |
|
|
|
Свой на Aqa.ru, Советник
 |
|
Daxel Костя, зря ты так: у меня если фиьтр встает, то приходят сине-зеленые. это почти на 100%. К тому же без фильтра все не айс.Может это полтергейс, но это так. К тому же биофильтрация нужна.... |
|
|
10/08/2013 21:22:02
#1850118 |
|
Свой на Aqa.ru, Советник
 |
|
сообщение Sebbb Гммм... Поиграем в испорченый телефон?  сообщение 666sb 
|
|
|
10/08/2013 22:01:36
#1850122 |
|
Свой на Aqa.ru, Советник
 |
|
Daxel )))) видимо я разговором с Женей был увлечен и не зметил что практик из Кургшага молвит )))) |
|
|
10/08/2013 22:48:58
#1850129 |
|
|
|
Посетитель
  |
|
Daxel Просьтите, если влезаю, но не могли бы Вы пояснить это утверждение. Видимо в очередной раз.  Тема интересна и новичкам, подписался, читаю с интересом, хоть и многое пока не понимаю. Голова пухнет. )) Прочитал несколько раз, но в голове пока не укладывается это утверждение, особенно непонятно, "тот CO2, что уже растворен" - когда растворен и как, ведь концентрация CO2 динамическая должно быть величина? Если CO2 между водой и воздухом всегда приходит в равновесную концентрацию, то при подаче в аквариум, он выветривается как в атмосферу, так и в дропчекер. Или атмосферный CO2 отличается от "принудительного" как-то... ? |
|
|
11/08/2013 00:40:57
#1850145 |
|
Свой на Aqa.ru, Советник
 |
|
Userchek Растворимость газов в воде зависит от парциального давления и температуры. Вот еще. При растворении СО2 в воде образуется угольная кислота, которая снижает величину рН . При принудительном растворении СО2 в воде его концентрация становится больше той концентрации, которая возможна при его растворении из атмосферы, поэтому СО2 начинает выветриваться в атмосферу и в пузырек дропчекера. И чем больше разница между принудительной и равновесной концентрациями газа, тем больше скорость его выветривания из воды . Величину рН можно измерить любым способом. В данном случае, когда рН и КН аквариумной воды меньше рН и КН раствора дропчекера, это могут быть даже тест-полоски, которые обычно не рекомендуют, потому что концентрация СО2 в воде соответствует концентрации СО2 в воздухе. А "уже растворенным" СО2 может быть несколькими способами. Если он есть в водопроводной воде, когда водозабор организован из реки, озера или водохранилища, то обратноосмотическая мембрана его пропустит, и вода из фильтра обоатного осмоса будет иметь рН меньше 7. Если в водопроводной воде нет СО2, что встречается в воде из артезианских скважин, то и в воде после обратноосмотического фильтра СО2 тоже не будет, и ее рН будет равна рН воды в водопроводе. Но после отстаивания и/или аэрации осмотической воды ее рН будет снижаться из-за растворения СО2 из атмосферного воздуха, а его концентрация в воде будет стремиться к равновесной. СО2 растворен, рН воды снижен, но рН воды можно измерить тестом на рН, а концентрация СО2 в воде равновесна с концентрацией СО2 в атмосфере, поэтому дропчекер ничего не покажет. При принудительном растворении СО2 можно было бы определять рН и КН воды капельными тестами, хорошо при этом взбалтывая пробы воды, чтобы избавиться от излишков СО2 в пробе, а потом вычислять равновесную концентрацию СО2 и складывать ее с концентрацией СО2, определенной по дропчекеру, но на рН и КН оказывают влияние подкисляющие и подщелачивающие вещества, меняющие состав воды независимо от растворения в ней СО2. Например, принудительное внесение в воду раствора соды приведет к ее подщелачиванию, а настой торфа - к подкислению. Думаю понятно, что бессмысленно пытаться определять концентрацию СО2 в воде по ее рН и КН, на которые влияют другие соединения. То есть, все методики проведения тестов есть, и тесты есть, и многие их проводят со своей аквариумной водой, но не всегда тесты показывают то, что хочет определить аквариумист. Изменено 11.8.13 автор Daxel |
|
|
11/08/2013 09:51:56
#1850171 |
|
Свой на Aqa.ru, Советник
 |
|
Daxel Костя, спасибо за развернутый ответ, но отредактируй ссылки: появилась горизонтальная прокрутка и на маленьких мониторах очень неудобно. |
|
|
11/08/2013 10:08:36
#1850173 Нравится 666sb
|
|
|
|
Свой на Aqa.ru, Советник
 |
|
Sebbb Ссылки отредактировал и добавил ссылку про выветривание. |
|
|
11/08/2013 12:05:34
#1850210 |
|
Завсегдатай
    |
|
Daxel вы знаете.. когда то у меня в аквариуме не было травы, в фильтре лежала биокерамика...видно было бактеральные домики в нынешнем аквариуме тоже пробовал насыпать биокерамику... биостартером даже полили... через 3 месяца керамика так и осталась чистой и белой..ни кто на ней не поселился теперь в фильтре только поролон и слой синтепона после позавчерашней капитальной стирки наполнителей вспышки синезелых почему то не произошло ))) |
|
|
11/08/2013 12:28:32
#1850215 |
|
Свой на Aqa.ru, Советник
 |
|
сообщение 666sb Продайте свой фильтр, если он Вам не нужен.  Или сравните площадь поверхности наполнителей своего фильтра с площадью поверхности хотя бы частиц грунта в своем аквариуме. Не объема, а площади поверхности. Хотя, для понимания, можно и объемы сравнить.  Если Вы не видите бактерии на грунте, траве, стеклах, шлангах и в воде, то это не значит, что их там нет. Просто биологическая нагрузка в Вашем конкретном аквариуме на колонию бактерий не такая уж и большая. А зависимость между бионагрузкой и потреблением кислорода для окисления органики даже математически описана. Вот, например, тема с этого форума: о магических формулах: обьем/час, обьем/сутки, etc. и о магических формулах: обьем/час, обьем/сутки, etc. . Формула Хираямы, которая там упоминается: 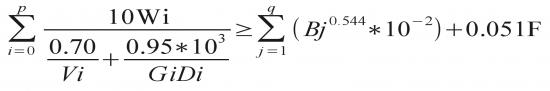 По ссылкам из той темы Вы ничего уже не найдете. Эта картинка из моего опуса о фильтрах . |
|
|
11/08/2013 14:14:34
#1850238 |
|
|
|
Завсегдатай
    |
|
Daxel не продам  гавномешалка и механическая очистка в травнике нужна гавномешалка и механическая очистка в травнике нужна площадь поверхности грунта и площадь наполнителей фильтра не изменилась  а что изменилось? изменилось- появилось много активных растений )) может дело в этом? ...что активные растения являются конкурентами для бактерий за легкодоступный азот? и роль именно фильтра как девайса, в биофильтрации становится не принципиальной |
|
|
11/08/2013 18:13:04
#1850313 |
|
Завсегдатай
    |
|
Daxel бактерий в грунте вижу- точнее продукты жизнедеятельности, на стыке грунт стекло бионагрузка... ну не сказал бы что маленькая снимки старые, месяца 3 назад сделаны, сосчитайте сколько бионагрузчиков))... и это, не столь популярные в травниках, неоны ))))) а чуть более крупные рыбы )) на снимке даже не все и уже подросли ) и тем не менее сине-зеленых нет)) может дело не фильтре? а в повальном увлечении прожекторами, >=1втл ? с какой целью?)) и ни чем не подкрепленной интенсивностью света? Изменено 11.8.13 автор 666sb |
|
|
11/08/2013 18:33:11
#1850316 |
|
Свой на Aqa.ru, Советник
 |
|
сообщение 666sb Кроме "легкодоступного азота" существует и другая органика. Но если Вы не в курсе, то я и объяснять не буду, потому что места в этой теме будет мало. Да и оффтопик там сплошной. 
|
|
|
11/08/2013 18:37:16
#1850319 Нравится 666sb
|
|
|
|
Завсегдатай
    |
|
Daxel да и не нужно)) с водорослями я расстался через год, после того как посадил первую травинку )) уверяю навсегда )) "другая органика"- выводится честными 30% подменами за оффтоп извиняюсь) а тема интересная, мне на пользу пошла  спасибо)) Изменено 11.8.13 автор 666sb |
|
|
11/08/2013 18:41:45
#1850320 |
|
Посетитель
  |
|
Daxel Большое Спасибо за развернутый ответ! Долго его осмысливал. Смысл отдельных предложений из вашего сообщения я думаю, что понимаю. И про выветривание и равновесную концентрацию, и про растворение, и про уменьшение pH. Все это читал, и прочитал еще раз. Но почему дропчекер будет врать я не совсем понимаю, т.е. где-то в вашем сообщении был переход от теории к причине "вранья", и я его не заметил. Вероятно, это уже будет офтопик, и для таких моментов надо отдельную тему в разделе для непродвинутых новичков создавать.  Но я, похоже, пока смогу понять только "на пальцах"... Можно я тогда еще пару глупых вопросов задам для уточнения: Но я, похоже, пока смогу понять только "на пальцах"... Можно я тогда еще пару глупых вопросов задам для уточнения: Правильно ли я понял, что вся фишка именно в неточности реакции индикатора на концентрацию CO2 в растворе дропчекера, который скорее реагирует аналогично тестами на ph и kh воды (которые не всегда точны), нежели на реальную концентрацию. То есть, я понимаю так, что: "концентрация, определяемая дропчекером" = "концентрация, определяемая по табличке замеренных капельными тестами kh+ph" !=(не равна) "реальная концентрация CO2". То есть, с точки зрения физики, химии и пр. законов природы, реальная концентрация CO2 внутри жидкости дропчекера будет стремиться к реальной концентрации в аквариумной воде, но окрашиваться он будет уже не совсем правильно? Например, Daxel Тут то мне и непонятно. Если концентрация CO2 растет -> падает PH, если концентрация CO2 падает -> растет PH. То есть, откуда бы не взялась вода, ее PH, аналогично CO2 за счет выветривания последнего изменится и придет к равновесному значению с аквариумной водой. Неправильно понимаю ? Вероятно, что-то из базовых вещей ранее зафиксировалось у меня в голове неверно. И еще спрошу - читая тему, я понял, что природная концентрация CO2 как правило крайне мала по сравнению с принудительно подаваемой, и ее можно считать почти погрешностью? В любом случае заранее спасибо! 
|
|
|
12/08/2013 12:01:52
#1850564 |
|
Свой на Aqa.ru, Советник
 |
|
сообщение Userchek Давайте я лучше по табличке объясню, чтобы было понятнее. Для примера возьму рекомендации "а-ля Амано": рН=6,6-6,7, КН=4. Эти значения соответствуют концентрации СО2 в воде около 30 мг/л по таблице. Но на рН и КН влияют не только СО2, угольная кислота и ее соли, но и другие соединения, растворенные в воде, поэтому эти даже табличные значения не являются точными. Это, скорее, ориентировочные числа. Можно считать, что значения рН и КН в таблице являются реальными при равновесной концентрации СО2 в воде. Но можно считать, что эти значения достигнуты благодаря принудительному растворению СО2 в воде. И то, и другое будет верным. Чтобы понять, сколько же реально СО2 в воде, нужно провести тесты на рН и КН тщательно взболтав пробы воды, чтобы СО2 выветрился, а потом провести те же тесты несколько раз, не взбалтывая пробы воды, и усреднив полученные значения. После этого сравнить усредненные значения тестов с теми, пробы воды в которых были взболтаны для выветривания СО2. Разница даст ориентировочную концентрацию СО2 в воде. Точнее это можно определить, если провести специализированный лабораторный тест на СО2 , но для этого понадобится и некоторое оборудование. С дропчекером проще. Выше я выкладывал фотографию теста рН дистиллята с добавлением одной капли раствора соды. На левой части фотки - рН самого дистиллята. Его КН=0. По таблице рН/КН/СО2 это примерно соответствует концентрации СО2 в 40 мг/л. Это - равновесная концентрация СО2 с атмосферой. А у раствора дропчекера КН=4 и рН цветового перехода индикатора бромтимоловый синий равен 7,6. Но при равновесной с атмосферной концентрации в растворе дропчекера будет всего 3 мг/л СО2 по таблице рН/КН/СО2, и цвет раствора будет синим и на открытом воздухе, и в воде с любыми рН и КН при равновесной концентрациии СО2. При точном изготовлении раствора для дропчекера, он будет точным, но только при избыточной концентрации СО2 в воде, когда его концентрация выше равновесной и без учета этой равновесной концентрации. "На пальцах" я уже объяснял. В дистилляте или в осмосе, при рН=6 и КН=0 уже есть 40 мг/л СО2, но дропчекер его не покажет. Добавив еще 30 мг/л СО2 в эту воду мы увидим изменение цвета раствора дропчекера на зеленый, который покажет 30 мг/л. А на самом деле там 40+30=70 мг/л СО2. Естественно, что КН меньше нуля не будет, но рН воды будет меньше первоначального значения 6,0. Дропчекер покажет избыточную концентрацию СО2 по отношению к равновесной (30 мг/л), а не реальную (70 мг/л). В воде с рН=7 и КН=4 растворено около 13 мг/л СО2. Это - равновесная концентрация. Подавая СО2 принудительно, получим, например, рН=6,6 и КН=4, но концентрация СО2 будет около 30 мг/л, и раствор дропчекера будет зеленым. Еще раз повторю: дропчекер показывает только избыточную концентрацию СО2, потому что газ выветривается в атмосферу и в пузырек дропчекера. Но сколько ни тряси, ни продувай и не выветривай дистиллят с рН=6, КН=0 и СО2=40 мг/л, газ из этой воды не выветрится, потому что это его равновесная концентрация. Реальная концентрация СО2 в растворе дропчекера на воздухе равна его равновесной концентрации. В воде с принудительно растворенным СО2 раствор дропчекера покажет избыточную концентрацию СО2, потому что он выветривается в пузырек дропчекера, создавая повышенную (избыточную) концентрацию СО2 в газовой смеси этого пузырька по отношению к атмосфере. сообщение Userchek Лично у меня, вернее, в моей водопроводной воде нет растворенного СО2, хотя по таблице рН/КН/СО2 в моей воде его должно быть около 3 мг/л. У нее рН=8, КН=8. Но вода у меня артезианская, причем ее общая жесткость в 4 раза больше ее общей щелочности - GH=2, что говорит о том, что в моей водопроводной воде примерно 6dKH приходится на анионы растворенной соды - NaHCO3. Такой уж у моей водопроводной воды природный состав. Так вот, в этой воде СО2 вообще не растворяется. Он может присутствовать в ней только в виде газа, для чего мне приходилось использовать только активные реакторы. При пассивных реакторах газ вообще не растворялся в моей воде. И сколько бы я ее ни отстаивал, сколько бы не продувал воздухом, ее рН и КН абсолютно не менялись. Другое дело с этой же водой, но после ее дистилляции или осмоса. До них рН=8. После дистилляции рН воды выше верхнего значения теста, потому что в теплой дистиллированной воде практически нет растворенных газов, а после осмоса рН=8, как и перед осмосом. Но при отстаивании и осмоса, и дистиллята, их рН уменьшается в связи с растворением СО2 из атмосферы. И уже этот атмосферный СО2 определяет рН воды. У меня для осмоса и дистиллята обычно рН меньше 6-ти. Какие значения рН и КН в осмосной воде, если в водопроводной воде растворен СО2, я не знаю, потому что у меня в городе вообще нет такой воды. У нас только артезианская. У форумчан из Москвы, например, осмос сразу с рН меньше 6, но об этом я сужу только по их сообщениям, потому что не могу этого проверить. Может быть кто-то из таких людей и откликнется в этой теме. сообщение Userchek Ну да! А дождевая вода? Это же чистый дистиллят. Там рН может быть и меньше 5-ти. Ссылка : При 0 градусов Цельсия и давлении 1 атмосфера концентрация СО2 = 3371 мг/л. При 20 С = 1705 мг/л СО2. |
|
|
12/08/2013 16:05:17
#1850634 Нравится Userchek
|
|
|
|
Посетитель
  |
|
сообщение Daxel Все! Наконец даже я понял!  Спасибо за подробный ответ с примерами! До меня не доходил тот факт, что равновесная концентрация у воды с разными параметрами разная! Не знаю уж, почему, но у меня засело в голове, что если в воздухе есть определенное количество CO2, то вода любых параметров стремиться при обмене с этим воздухом к одинаковой концентрации CO2 в этой воде. Отсюда и непонимание. Пример с дистиллятом и дождевой водой ярко намекнул. Спасибо за подробный ответ с примерами! До меня не доходил тот факт, что равновесная концентрация у воды с разными параметрами разная! Не знаю уж, почему, но у меня засело в голове, что если в воздухе есть определенное количество CO2, то вода любых параметров стремиться при обмене с этим воздухом к одинаковой концентрации CO2 в этой воде. Отсюда и непонимание. Пример с дистиллятом и дождевой водой ярко намекнул.  Получается, что вода с разными KH по разному "делится" с воздухом этим самым CO2. И вероятно отсюда можно сделать вывод, что чем ближе параметры аквариумной воды к раствору дропчекера (по KH или еще по чему-то), тем меньше привирает индикатор. Получается, что вода с разными KH по разному "делится" с воздухом этим самым CO2. И вероятно отсюда можно сделать вывод, что чем ближе параметры аквариумной воды к раствору дропчекера (по KH или еще по чему-то), тем меньше привирает индикатор. сообщение Daxel Это я так понимаю только для определения равновесной концентрации, и определения "погрешности" дропчекера. Когда измеряю PH воды, наоборот, стараюсь ее не шевелить лишний раз, чтобы ничего не успело выветриться и определить PH с "накачаным" туда газом. сообщение Daxel Ужасные цифры. Но тут я так понял речь про растворимость с чистым CO2, а не с воздухом. Изменено 12.8.13 автор Userchek |
|
|
12/08/2013 17:36:35
#1850661 |
|
Свой на Aqa.ru, Советник
 |
|
сообщение Userchek Естественно. Если у воды КН=4 и у раствора дропчекера КН=4, то равновесная концентрация СО2 у них будет одинаковой, но только при условии, что у воды КН определяют соли угольной кислоты. сообщение Userchek Только для определения параметров равновесной концентрации СО2, для определения реальных рН и КН. Дропчекер реагировать вообще не будет, пока избыточный СО2 в его газовоздушном пузыре не начнет изменять рН его раствора. А изменение рН раствора дропчекера приведет к изменению цвета его индикатора. Эти индикаторы работают при изменении рН растворов. Помните школьную химическую поговорку? "Фенолфталеиновый от щелочи малиновый. Но не смотря на это, в кислотах он без цвета". Фенолфталеин - химический индикатор, меняющий цвет при изменении рН раствора. сообщение Userchek Вообще-то я приводил ссылку на парциальное давление. В ней говорится, что при растворении газа играет роль концентрация этого газа в составе газовой смеси, а не чистота газа. Если это принять за аксиому, то при одинаковых давлениях и температурах в одинаковых объемах воды растворится одинаковое количество газа одного и того же газа, что чистого, что в смеси с другими газами. |
|
|
12/08/2013 18:03:55
#1850671 |



 Загружаю
форму....
Загружаю
форму....