|
Посетитель
  |
Смешивание хелаторов. (страница 3) |
|
Вопрос заключается в том, что бы при приготовлении МИКРО удобрений смешивать хелаторы в одном флаконе. |
|
|
13/11/2020 10:51:48
#2837884 |
|
Посетитель
  |
|
MTumanov 60%EDTA 30 DTPA остальное глюконат железа Vadim_chikТаблицы разные бывают какой верить? |
|
|
15/11/2020 01:57:02
#2838581 Нравится MTumanov
|
|
|
|
Завсегдатай
    |
|
Лоренсо Фон Матерхорн Ну тогда просто логика.. Как вы думаете, стали бы аквариумисты использовать хелат, который по вашим словам разрушается при 6.5 и при 7. 5? Такие рН у каждого второго.. Тут даже по справочника лазать не нужно |
|
|
15/11/2020 02:13:16
#2838582 Нравится Aqua Chillout
|
|
Свой на Aqa.ru
     |
|
|
15/11/2020 03:05:37
#2838590 Нравится Лоренсо Фон Матерхорн
|
|
Завсегдатай
    |
|
MTumanov Странная таблица.. Да еще и про Fe 3+.. При таком рН даже Fe2(SO4)3, без какого либо хелата, какое то время продержится, вывалится конечно, но не сразу. Fe2(SO4)3 точно выдерживает аквариумный рН, проверенно... Глюконат железа 3+ не вываливается до рН-9, дальше не проверял. Цитрат железа 3+ я не смог вывалить в осадок даже при рН выше 9 (а ведь это все более слабые хелаторы, чем ДТПА) Раствор ДПТА железа 3+ (самодельный, а не покупные пакетики) я лично поднимал рН до 10 и он сутки спокойно простоял, без какого либо осадка.. Все это можно проверить самим... Так что для меня странно выглядит эта таблица устойчивости, да еще и для железа 3+ PS Возможно, какой то ответ, можно получить из этой 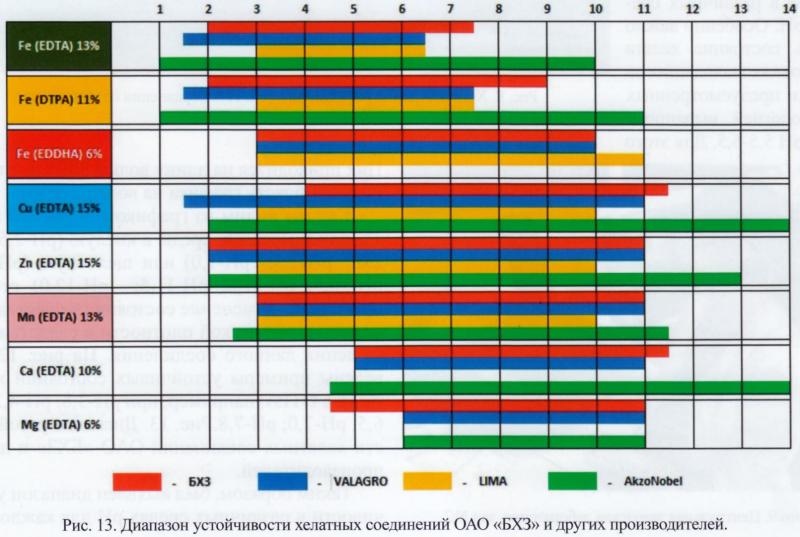 Тут мы видим, что один и тот же хелат, у разных производителей ведет себя по разному... Зададимся вопросом почему? Не потому ли, что тупо не докладывают хелат? Или как еще объяснить, что самодельный ДТПА железа 3+ прекрасно укладывается в диапазон рН от 2х до 11ти ? Изменено 15.11.20 автор Vadim_chik |
|
|
15/11/2020 03:59:01
#2838591 Нравится MTumanov, Aqua Chillout
|
|
Свой на Aqa.ru
     |
|
Vadim_chik Там кроме таблицы ещё много страниц текста с указанием источников. Ссылку я привёл. А вот ссылка на статью, картинку из которой Вы приводите. Хелатные микроэлементы Хелатэм™ Исследование проводил Буйский химический завод. Vadim_chik А где Вы покупаете хелатор ДТПА? Я в продаже вижу только ЭДТА (Трилон Б). |
|
|
15/11/2020 13:04:25
#2838647 |
|
|
|
Завсегдатай
    |
|
MTumanov Да знаю я про ссылки.. Я ковыряю потихоньку справочники, но не так что бы уж очень старательно. Думаю тут недопонимание в том, что в таблицах у амании, указывают диапазон наиболее устойчивого состояния FeДПТА 3+.. Потому как не разрушается он при рН 7.5 и при 8ми тоже не разрушится. У меня сейчас, моя "лаборатория" вся упакована и спрятана. Распаковывать уж очень лениво.. Проведите эксперимент. Создайте раствор лимонки с железным купоросом. Затем залевайте аптечной перекиси водорода до тех пор, пока раствор не станет темно-чайного цвета.. Таким образом Вы получите раствор Fe 3+. Затем отдельно создайте раствор щелочи (например КОН) и покапельно, при помощи щелочи, поднимите рН рабочего раствора до рН 8.. Отфильтруйте и оставьте на сутки.. Это заведомом более слабый хелат, нежели ЭДТА или ДТПА. Тоже самое можно сделать с глюконатом железа или с железным купоросом MTumanov На барахолке чемпорта купил как то чда Но задорого |
|
|
15/11/2020 14:06:52
#2838664 |
|
Свой на Aqa.ru
     |
|
Vadim_chik У меня нет доступа к лабораторному оборудованию. А дома ни места ни условий для нормальных исследований нет. Многие реактивы в открытой продаже отсутствуют. Глюконат железа надо самому синтезировать, из глюконата кальция. Глюконат кальция есть на rushim.ru Кальций глюконат, имп 98,5+%, цена за 1 кг - 380 руб. Vadim_chik Случайно повезло. Цитата из chemport.ru "Cамый распространённый и дешёвый хелат Fe-ЭДТА имеет ряд существенных недостатков и ограничений как: Вот собственно почему применяется более стабильный глюконат железа, который в свою очередь имеет ещё больше недостатков, чем ЭДТА." Источник. Изменено 15.11.20 автор MTumanov |
|
|
15/11/2020 17:05:17
#2838715 |
|
Завсегдатай
    |
|
MTumanov Зачем вы приводите цитату не химика, а человека, который наверняка использовал те же самые данные, что выложены на амании? Почитайте ответ химика Авор, который отвечает на пост с этими утверждениями. Не надо путать переход железа в степень окисления 3+ и разрушение комплекса цитата химика Авор . При разговоре с химиками надо учитывать, что они под устойчивостью комплексов понимают совсем не то, что вы, и так надо поступать с любой терминологией. Вас интересует процесс перехода железа II в железо III в присутствии кислорода. В химии оно имеет отношение к устойчивости комплексов железа весьма опосредовано. |
|
|
15/11/2020 17:44:46
#2838730 |
|
|
|
Свой на Aqa.ru
     |
|
Vadim_chik А откуда известно, что пользователь с ником "teapot" не химик? |
|
|
15/11/2020 18:17:56
#2838745 |
|
Завсегдатай
    |
|
MTumanov У человека, всего 5 вопросов на форуме. и он о себе пишет: Буду рад помощи, только не пинайте сильно, плиз, я вообще ни разу не химик. Но суть не в этом.. Я кажется начинаю понимать. Мы говорим на разных языках.. Я услышал фразу "разрушение" и увидел таблицу с Fe 3+. Я говорю только о том, что разрушаться Fe (3+) ЭДТА и ДТПА при рН равных 6.5 и 7.5 не будет.. Во всяком случае не за время необходимое аквариумистам.. Мне приходилось проводить эксперименты с этими хелатами при рН выше указанных.. Проверял обычно в течении суток (больше не требуется) Тот эксперимент, что я предложил Вам сделать, я уже проделывал.. Что бы продемонстрировать еще раз и сделать фото, мне нужно разбирать свои коробки с химикатами и посудой, чего мне делать лениво.. Но если Вы, захотите, то можете убедится, что такой рН сможет выдержать даже просто сульфат железа 3+, без какого либо хелата (ну тут правда не долго) |
|
|
15/11/2020 18:25:34
#2838749 |
|
Свой на Aqa.ru, Кандидат в Советники
      |
|
Vadim_chik Кстати, в том же ответе, Авор допускает возможность смешивания Fe ЭДТА с глюконатом железа. |
|
|
15/11/2020 18:30:36
#2838752 |
|
|
|
Завсегдатай
    |
|
Alex Livci Алекс, если Вы, найдете достоверную информацию о том, что происходит при смешивании глюконата и трилонов железа, я буду Вам безмерно благодарен.. Я не отрицаю (и многократно это говорил), что данный состав у нас, аквариумистов работает.. Но точных данных, что происходит и будет ли разрушение глюконата железа Fe 2+ в присутствии ЭДТА/ДТПА у меня нет и найти я их не смог PS Химики утверждают, что глюконат железа 2+ должен быть разрушен Изменено 15.11.20 автор Vadim_chik |
|
|
15/11/2020 18:34:17
#2838755 |
|
Свой на Aqa.ru, Кандидат в Советники
      |
|
Vadim_chik Странно, у меня в цихлиднике с более высоким PH (7.6 без газа и 7.2 с газом) ЭДТА железо через день примерно наполовину куда-то "уходит". Можно было бы предположить потребление растениями, но с ДТПА железом такого не происходит - концентрация держится весьма стабильно. Но так как я брал аквамикс, а не хелатировал сам, то там запросто могли и недохелатировать железо, конечно. |
|
|
15/11/2020 18:36:29
#2838759 |
|
Завсегдатай
    |
|
vstakhov в банке с растениями Вы не можете как либо делать выводы.. Например такой аргумент, что чем ниже константа устойчивости хелата, тем проще растению получить ион железа ? С эдта железо может потреблятся быстрее растениями и разрушатся другими факторами (бактерии например) и куча-куча-прочего, чего мы можем просто не знать.. Это не чистый эксперимент.. Это можно просто учитывать |
|
|
15/11/2020 18:41:41
#2838763 |
|
|
|
Свой на Aqa.ru, Кандидат в Советники
      |
|
Vadim_chik Это понятно, но опять же в травнике с более низким PH ЭДТА держался гораздо стабильнее, хотя потребителей в травнике явно больше. Проблема в том, что на чистый эксперимент особо нет ни времени, ни возможностей, да и капельные тесты - это явно не масс-спектрография в плане точности. |
|
|
15/11/2020 18:56:01
#2838774 Нравится Лоренсо Фон Матерхорн
|
|
Свой на Aqa.ru
     |
|
|
Про потребление вообще сложный вопрос. Собственно есть потребление в виде впитывания тканями растения, и ассимиляция - синтез тканей из питательных веществ. И если подумать, то всё не просто и неоднозначно. Для большего потребления нужна большая масса растения, для быстрой ассимиляции нужны условия для быстрого роста. |
|
|
15/11/2020 19:01:55
#2838779 |
|
Завсегдатай
    |
|
vstakhov Было бы интересно, если бы вы попробовали провести тот же эксперимент, но не с покупными пакетиками. Я против них ничего не имею, но все же.. И к тому же.. Вы же сами сказали, что при всем, при этом, в весьма агрессивной среде (а аквариум для железа агрессивная среда) в аквариуме, через день, железо остается )) Если бы хелат разрушался, он бы разрушился весь.. с какого перепугу, что-то остается? Вывод не может быть таким, что есть разница в потреблении и нам просто не понятно условие? По поводу тестов на железо.. ох уж эти тесты.. Попробуйте как нибудь провести интересный эксперимент. Создайте в колбе заведомо известную концентрацию ЭДТА железа и в другой колбе такую же концентрацию ДТПА железа.. и сравните тестами.. Возможно Вас результат удивит.. PS дело в том, что с захелатированным железом, далеко не все тесты нормально работают |
|
|
15/11/2020 19:08:46
#2838782 |
|
|
|
Свой на Aqa.ru
     |
|
Vadim_chikВадим, а нужен ли нам устойчивый комплекс? С таким комплексом железо начнёт накапливаться. |
|
|
15/11/2020 19:14:05
#2838787 |
|
Свой на Aqa.ru
     |
|
Vadim_chik А что для Вас является достоверной информацией? Например, цитата. "Концентрационная константа устойчивости комплексоната не зависит от концентрации участников реакции и величины рН раствора. Величина константы, а следовательно, устойчивость комплексоната, определяется природой иона металла, его зарядом, радиусом и электронным строением, ионной силой раствора, природой растворителя и температурой. Чем больше константа, тем более устойчив комплексонат. В табл.1 приведены численные значения логарифмов констант устойчивости комплексонатов некоторых металлов с ЭДТА в водном растворе при 200С и ионной силе 0,1." Для Fe+ (II)-ЭДТА логарифм константы устойчивости равен 14,3 Источник. Если найдёте константу устойчивости для глюконата железа, то это и есть ответ на Ваш вопрос. Однако, глюконат железа изучен существенно хуже, чем Fe-ЭДТА. Найти информацию по константам устойчивости глюконата железа мне не удалось. Например, можно сравнить константы устойчивости для гумусовых кислот и цинка. PDF: Определение концентрационных констант устойчивости комплексов ионов тяжелых металлов с гумусовыми кислотами. Zn (II)-ЭДТА = 16,5 Zn (II)-(гуминовая кислота) = 4,73 Это общеизвестно, что константа устойчивости глюконовой кислоты меньше, чем ЭДТА. И комплексообразователь, у которого константа устойчивости больше, будет перехелатировать на себя ион металла из более слабого комплексообразователя. Кстати, "Трилон" это торговая марка фирмы BASF. "Трилон Б" это ЭДТА. "Трилон С" это ДТПА. Так что говорить просто "трилон" - неточно. Правда, слово "трилон" уже давно стало нарицательным, примерно как "ксерокс". А "Трилон 83" это вообще из другой области. :-) |
|
|
15/11/2020 19:19:40
#2838792 |
|
Свой на Aqa.ru
     |
|
MTumanovСведения о трилонах у вас устаревшие. На сегодня есть перспективный трилон М, на основе глицина.Работает в очень широком спектре пш. |
|
|
15/11/2020 19:36:37
#2838799 |
|
|
|
Свой на Aqa.ru, Кандидат в Советники
      |
|
Vadim_chik По глюконату мало чего удается найти. Но что-то при смешивании точно происходит. Предположу что смешивая ЭДТА Fe3, с глюконатом Fe2, глюконат быстрее переходит в 3. А если так, то комплекс получает еще большую устойчивость, ведь не с проста такая смесь устойчива к качественной реакции, даже при повышении pH до 12, гидроксидов не выпадает, раствор остается прозрачным. Я точно не помнню. Но примерно константа устойчивости глюконата Fe2 около 17, а Fe3 там сильно выше, что-то около 40. Когда как у ЭДТА для Fe2 примерно 15, а для Fe3 25. Так что тут если и возможн перекомплекс, то большой вопрос кто у кого вырвет) |
|
|
15/11/2020 19:37:27
#2838800 |
|
Завсегдатай
    |
|
Alex Livci Алекс. С глюконатами есть нюанс.. Я не просто так выделяю степени окиления железа в глюконате.. Глюконат железа 2+ создается под воздействием t. А вот с ионом железа 3+ глюконовая кислота входит в реакцию и без t. Мало того, глюконат может отобрать ион железа 3+ у ЭДТА ))) Забавно, да? Из разговоров с химиками, я понял этот вопрос так.. Если подать глюконат железа 2+ в раствор, в котором будут присутствовать трилоны, то ион железа будет у трилона. Но как только, железо перейдет в степень окисления 3+ (а это неизбежно) глюконат восстановится в глюконат железа 3+ (актуально для эдта).. PS Вот кстати, что об этом пишет химик Амик (правда он уточняет, что это актуально для рН 6-7 MTumanov Я даже комментировать все это не буду ((((( Изменено 15.11.20 автор Vadim_chik |
|
|
15/11/2020 20:00:02
#2838814 |
|
Свой на Aqa.ru
     |
|
Hedin Так я уже тридцать лет как химией больше не занимаюсь. Все мои знания в области химии основательно устарели. Таблица Менделеева и та теперь выглядит не так, как тогда когда я работал. |
|
|
15/11/2020 20:25:39
#2838822 |
|
|
|
Свой на Aqa.ru
     |
|
Vadim_chik Я постараюсь освежить свои знания по химии комплексонов. Поспрашиваю знакомых, правда в живых уже мало кого осталось, а из них в области химии работают единицы. Если что найду по глюконату железа - сообщу. Помню, что с комплексонами всё очень непросто, так что вполне возможно, что я тут наговорил некоторое количество глупостей. |
|
|
15/11/2020 21:09:42
#2838851 |
|
Свой на Aqa.ru, Кандидат в Советники
      |
|
Vadim_chik Ну, даже глюконат "уходит" не сразу, а по прошествии какого-то времени. А вот что при этом происходит: потребление или же химическое осаждение, я не совсем понимаю. Кстати, когда у меня был выше PH, то попадание глюконата сразу же провоцировало бактериальную вспышку где-то на полчаса-час. А сейчас, с PH в районе 6.7, такого не происходит. Vadim_chik Угу, я этот тест (JBL) сразу проверил на трех хелатах железа, что были в хозяйстве: глюконате, ЭДТА и ДТПА - везде тест все показал достаточно четко. А вот в местном микро (копия EasyLife ProFito) железа не нашлось... Hedin С большими регулярныеми подменами накопления происходить не будет, но вот неостановимую вспышку бороды пока удается сдерживать только глюконатом. Никакие сайдексы, перекиси и подмены по 70% каждый день не помогали. С другой стороны, с глюконатом практически перестали расти мхи: похоже, что с таким железом преимущество получают именно сосудистые высшие растения, которые умеют накапливать железо быстро и эффективно. А вот с постоянно высокой концентрацией железа, там все прет - и желательное, и нежелательное. |
|
|
15/11/2020 22:00:15
#2838874 |







 Загружаю
форму....
Загружаю
форму....