|
Постоянный посетитель
   |
СО2 больше в мягкой воде. Миф или нет? |
|
Не могу понять, правда ли это? сообщение ашык А мне до сих пор не понятно. Может поделитесь мыслями по этому поводу? а вот почему жёсткая вода должна как-то препятствовать самому растворению СО2 - не очень. Разделяю данную мысль. Хотя это и не очень важно - всегда можно применить активный реактор и насильно растворить все СО2 без остатка. Может быть, кто-нибудь возьмется объяснить по каким причинам в жесткой воде концентрация свободного СО2 может быть ниже, чем в мягкой, если был растворен одинкавый объем СО2? Для понятности объяснения предлагаю следующую модель: 1. Взяли 1 литр дистиллированой воды, полностью растворили в ней 10 мг углекислого газа. 2. Взяли 1 литр дистиллированной воды, развели в ней 1 г бикарбоната натрия , полностью растворили 10мг СО2. Почему концентрация свободного СО2 в случае 2 может оказаться меньше? Если она может оказаться меньше, то на сколько? |
|
|
11/10/2005 08:51:59
#239745 |
|
Постоянный посетитель
   |
|
|
Дабы освежить в памяти обсуждение "формулы толстяка" предлагаю перечитать тред рН, кН, формула Wampl’a и пузырьки СО2 на пальцах |
|
|
11/10/2005 08:59:26
#239748 |
|
|
|
Посетитель
  |
|
|
Эмипирическое объяснение дает принцип ла-шателье, кол-во примесей вляет на равновесие, скорость и направление реакций. |
|
|
11/10/2005 09:17:33
#239753 |
|
Завсегдатай, Советник
 |
|
|
САВА, ты ле-шателье не пугай, ты на пальцах давай, на пальцах |
|
|
11/10/2005 11:08:26
#239796 |
|
Завсегдатай
    |
|
|
Позвольте вставить наблюдение из практики. |
|
|
11/10/2005 11:45:23
#239813 |
|
Постоянный посетитель, Советник
 |
|
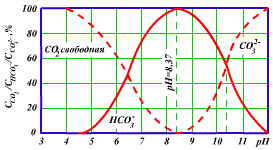
Согласен с предыдущими ораторами. На примере раствора соды несколько упрощенно я бы это сформулировал так: 1) в растворе бикарбоната натрия NaHCO3 всегда присутствует и карбонат Na2CO3. Присоединяя либо отделяя углекислый газ и воду одно переходит в другое, и между их концентрациями имеет место химическое равновесие. 2) При растворении СО2 в растворе соды часть углекислого газа уходит на реакцию Na2CO3+CO2+H2O -> 2NaHCO3 поэтому концентрация свободного СО2 оказывается в итоге ниже, чем в случае дистиллированной воды.
хотя такое утверждение (что в жесткой воде CO2 хуже растворяется), и высказывалось неоднократно, мне это остается непонятным. Подозреваю, что это все-таки не совсем так: жесткая вода не препятствует растворению СО2 как таковому, она препятствует сохранению СО2 в воде в свободной форме (см. выше). |
|
|
11/10/2005 12:04:12
#239826 |
|
Посетитель
  |
|
сообщение ашык На пальцах не получится, можно только порассуждать  Сам процесс растворения некоторая реакция итоговый продукт которой угольная кислота т.е. свободный со2. Для того чтобы газу растворится и образовать молекулу кислоты нужно получить доступ к свободной молекуле воды. Примеси уменьшают кол-во этих свободных молекул, образуя гидтратированые узлы Например: 0-NA(+)-0 0 это связаные молекулы, которые могут быть недоступны для процесса растворения газа. Т.е. увеличивая примесь ты уменьшаешь кол-во свободных молекул. Т.е. со2 растворяется хуже. Так сказать вольные фантазии на пальцах с помощью ла-шателье  Если вернутся в буферу, то конечно карбонат сожрет много со2 при преобразовании в гидрокарбонат NA2(CO3) + CO2 + H2O= 2NAHCO3 |
|
|
11/10/2005 12:11:02
#239834 |
|
Свой на Aqa.ru, Советник
 |
|
сообщение ашык Да, не должен. |
|
|
11/10/2005 12:13:45
#239835 |
|
Постоянный посетитель
   |
|
сообщение Dmitrii сообщение Fylhtq Одна исходная посылка, вроде, прорисовывается - растворяя 1г NaHCO3 в 1 литре чистой воды, мы получаем не только раствор NaHCO3, но и раствор Na2CO3. Зато возникают новые вопросы: Почему он должен появиться? Раз появился карбонат натрия, следовательно выделилось некоторое количество CO2? Если этот СО2 никуда не ушел из раствора, то именно такое количество CO2 и понадобится на "сжирание" только что образовавшегося карбонатного буфера. В чем тогда проблема? Изменено 11/10/05 автор Sebastian Pereira |
|
|
11/10/2005 12:30:10
#239838 |
|
Постоянный посетитель, Советник
 |
|
Почему он должен появиться? В результате реакции 2NaHCO3=Na2CO3 + CO2 + H2O. Эта реакция всегда идет как в прямом направлении, так и в обратном. Химическое равновесие достигается когда скорости этих двух противоположных процессов совпадают. Так что в воде всегда присутствуют как карбонат так и бикарбонат. Раз появился карбонат натрия, следовательно выделилось некоторое количество CO2? Да. См. выше. Если этот СО2 никуда не ушел из раствора, то именно такое количество CO2 и понадобится на "сжирание" только что образовавшегося карбонатного буфера. В том-то и дело, что в случае с природной жесткой водой этот СО2 уже давно ушел. Если же речь идет об искуственно приготовляемом растворе, то в сухом порошке бикарбоната натрия всегда присутствует также и карбонат, по тем же самым причинам. |
|
|
11/10/2005 12:52:29
#239849 |
|
|
|
Завсегдатай, Советник
 |
|
|
стоп. что-то тут не то. |
|
|
11/10/2005 12:59:26
#239853 |
|
Посетитель
  |
|
сообщение ашык На самом деле равно. Казус - ужос. Втыкнуть с первого раза невозможно  Растения употребляют в виде H2CO3, H+ и OH- используется для поддержания нейтрального заряда. Я предупреждал про ужос 
|
|
|
11/10/2005 13:02:59
#239856 |
|
Завсегдатай, Советник
 |
|
|
нет, не равно. |
|
|
11/10/2005 13:10:09
#239859 Нравится hdiscus
|
|
Посетитель
  |
|
|
Глубоко копаешь, ашык |
|
|
11/10/2005 15:29:57
#239904 |
|
Постоянный посетитель
   |
|
|
Может быть, это поможет кому-нибудь в рассуждениях 1.4. Углекислотное равновесие ? |
|
|
11/10/2005 16:36:48
#239922 |
|
|
|
Завсегдатай
    |
|
сообщение ашык Почему это? Как раз тут Продувка аквариума СО2 Женя Подсыпальников, когда первый раз огласил эту формулу пишит: "Нужный ритм пузырьков легко рассчитать, зная КН и объем воды в литрах (V), грубо: Число пузырей в минуту N = (KH * V) / 30 " и далее "И, конечно же, формула не для понижения рН газом. " Именно основываясь на этих знаниях я и сказал, что от КН зависит необходимая скорость пузыряния. Я где то не прав? Что то упустил? сообщение Sebastian Pereira Если говорить в продолжение темы "рецептов для бражки", то не понял суть вопроса. Более справедливо слово "растворен" заменить на "подан". С чего вы взяли что если газ подается с одинаковой скоростью и в мягкую и в жесткую воду, то он с одинаковой скоростью растворяется? Изменено 11.10.05 автор Buldozer |
|
|
11/10/2005 18:31:27
#239953 |
|
Постоянный посетитель, Советник
 |
|
сообщение Sebastian Pereira Да, это стандартные формулы. Именно на основе формулы (1.11) и рассчитываются пресловутые таблицы, связывающие содержание свободного СО2, рН и щелочность, в предположении, что щелочность обусловлена только ионами НСО3-. CaCO3 может выпасть в осадок и исчезнуть из системы. Выпасть в осадок еще не значит исчезнуть из системы. Выпавший в осадок CaCO3 может опять перейти в Са(HCO3)2 и раствориться при повышении концентрации свободного СО2. Это и наблюдается - при закачивании СО2 в воду известковый налет на листьях растворяется. Так или иначе, буферные свойства системы обеспечиваются связыванием СО2 при переходе карбонатов в гидрокарбонаты по приводишемуся выше уравнению, независимо от того идет речь о растворенных карбонатах, или выпавших в осадок. |
|
|
11/10/2005 20:06:55
#239983 |
|
Завсегдатай, Советник
 |
|
|
Buldozer, в середине треда про "пузырьки СО2 на пальцах" есть объясненение с цифрами - почему это так. |
|
|
11/10/2005 20:33:11
#239988 |
|
Постоянный посетитель, Советник
 |
|
|
Возвращаясь к вопросам в первом сообщении в этой ветке: сообщение Sebastian Pereira На мой взгляд, причина - это именно связывание свободного СО2 за счет преобразования карбонатов в гидрокарбонаты. Впрочем, это не мое изобретение, именно так всегда и везде и трактуется принцип работы карбонатного буфера. Те же соображения, которые высказал Ашык - оно может и умно, но как-то уж очень туманно.. и сыро (проклятая осень..  ). Может если б сформулировать это более четко, то оно и правильно, а так... я пока остаюсь при своем исходном мнении. ). Может если б сформулировать это более четко, то оно и правильно, а так... я пока остаюсь при своем исходном мнении. Если она может оказаться меньше, то на сколько? А вот на сколько именно - это уже надо считать. Надо выписать уравнения равновесия для имеющих здесь место реакций, дополнить их балансными уравнениями и совместно их решить. Думаю, для той упрощенной формулировки задачи, которая была предложена (СО2 полностью растворяется, ничего не выпадает в осадок и не уходит в воздух) этого будет достаточно. Дело это нехитрое, и давным-давно уже надо было бы это сделать. Если никто из "настоящих химиков" здесь в ближайшее время не даст ответ, то может я все-таки соберу волю в кулак и решу в конце концов эту элементарную задачку. 
|
|
|
11/10/2005 21:04:21
#239997 |
|
Завсегдатай, Советник
 |
|
|
то может я все-таки соберу волю в кулак и решу в конце концов эту элементарную задачку.
ага, значит не оскудела химиками земля aqa.ru  просим, просим 
|
|
|
11/10/2005 21:14:11
#240002 |
|
|
|
Постоянный посетитель
   |
Да... |
|
Все стало еще запутаннее. |
|
|
11/10/2005 23:52:47
#240057 |
|
Свой на Aqa.ru, Советник
 |
|
|
Интересно читать все эти соображения, но на мой взгляд, эффективность растворения СО2 звависит (в основном) от окисляемости воды (ХПК). Жесткость воды влияет в значительно меньшей степени. |
|
|
12/10/2005 08:16:00
#240122 |
|
Постоянный посетитель
   |
|
сообщение igor2 Прошу принять во внимание, что мой предыдущий пост с "мысленным экспериментом" был не более, чем бредом. Я по прежнему продолжаю считать, что содержание свободного СО2 не зависит от жесткости воды, т.е. от концентрации заранее введенного в воду HCO3- в виде соды. Просто наличие этого иона не позволяет pH сразу и быстро понизиться при растворении CO2. |
|
|
12/10/2005 09:26:32
#240140 |
|
Малёк

10
 20 года |
|
|
Странная штуковина происходит с банкой. |
|
|
12/10/2005 09:41:27
#240142 |
|
Посетитель
  |
|
сообщение Sebastian Pereira Это противоречит ла-шателье 
|
|
|
12/10/2005 11:27:36
#240181 |
|
|


 ).
). 
 Загружаю
форму....
Загружаю
форму....